题目内容
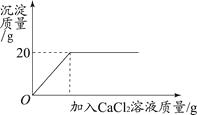
【题目】(3分)将一定质量的碳酸钠粉末溶于400g水中配制成溶液,取1/4该溶液,向其中加入20%的氯化钙溶液至不再产生沉淀(反应方程式为CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl),所得沉淀的质量与加入氯化钙溶液的质量关系如图所示,试计算碳酸钠粉末的总质量及恰好完全反应时所得溶液中溶质的质量分数。
【答案】84.8g 11.0%
【解析】
试题分析:发生反应方程式为CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl。产生100g沉淀消耗CaCl2质量是111g; Na2CO3的质量是106g。则产生20g沉淀消耗的CaCl2的质量是22.2g;Na2CO3的质量是21.2g。由于将一定质量的碳酸钠粉末溶于400g水中配制成溶液,取1/4该溶液,所以碳酸钠粉末的总质量21.2g ×4=84.8g. 恰好完全反应时所得溶液是NaCl溶液。溶液的质量是100g+21.2g+22.2g÷20%-20g=212.2g.NaCl的质量是(117×20g)÷100=23.4g,所以NaCl溶液中溶质的质量分数是23.4g÷212.2g×100%=11.0%。

 赢在课堂名师课时计划系列答案
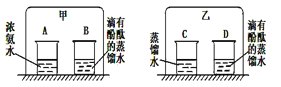
赢在课堂名师课时计划系列答案【题目】(8分)小明设计了如下图所示的实验装置来证明氧化铜也能加快过氧化氢溶液的分解,并与相同条件下MnO2的催化效果做比较,实验时间均以生成30 mL气体为准(即比较反应的快慢程度)。
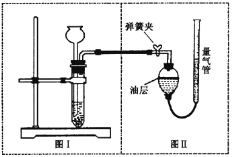
用图示装置测量产生气体的体积,其它可能影响实验因素均已忽略,相关数据如下:
实验序号 | 过氧化氢溶液体积 | 催化剂 | 待测数据 |
① | 15mL | 无 | |
② | 15mL | CuO(0.5g) | |
③ | 15mL | MnO2(0.5g) |
(1)检查图(Ⅰ)装置气密性的方法是: ;
实验②操作时图(Ⅰ)装置中加入药品和试剂的先后顺序是, (用化学式填写);
(2)图(Ⅱ)装置中油层的作用是阻止氧气与水的接触,防止氧气 。
(3)从设计原理看,实验中的“待测数据”是指 。
(4)如果要进一步探究CuO是否是该反应的催化剂,根据催化剂的定义,请完成下列实验。
实验步骤和现象 | 设计这一步骤的目的 |
(1)取15mL过氧化氢溶液,加入0.5g CuO后,产生O2的速率比未加入时快得多 | CuO能加快过氧化氢溶液的分解 |
| |