题目内容
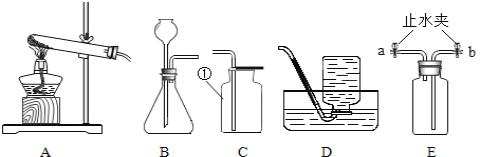
【题目】(8分)小明设计了如下图所示的实验装置来证明氧化铜也能加快过氧化氢溶液的分解,并与相同条件下MnO2的催化效果做比较,实验时间均以生成30 mL气体为准(即比较反应的快慢程度)。
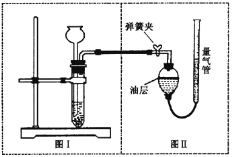
用图示装置测量产生气体的体积,其它可能影响实验因素均已忽略,相关数据如下:
实验序号 | 过氧化氢溶液体积 | 催化剂 | 待测数据 |
① | 15mL | 无 | |
② | 15mL | CuO(0.5g) | |
③ | 15mL | MnO2(0.5g) |
(1)检查图(Ⅰ)装置气密性的方法是: ;
实验②操作时图(Ⅰ)装置中加入药品和试剂的先后顺序是, (用化学式填写);
(2)图(Ⅱ)装置中油层的作用是阻止氧气与水的接触,防止氧气 。
(3)从设计原理看,实验中的“待测数据”是指 。
(4)如果要进一步探究CuO是否是该反应的催化剂,根据催化剂的定义,请完成下列实验。
实验步骤和现象 | 设计这一步骤的目的 |
(1)取15mL过氧化氢溶液,加入0.5g CuO后,产生O2的速率比未加入时快得多 | CuO能加快过氧化氢溶液的分解 |
| |
【答案】(1)方法一:在橡皮管上夹弹簧夹,向长颈漏斗内加水,至形成液封,再加适量水,静置一段时间后,若长颈漏斗液面与试管内液面差保持不变,说明气密性良好。方法二:在试管内加入适量水,形成液封后,用针筒接在橡皮管上,当针筒外拉或内推时,若看到试管内有气泡或长颈漏斗下端出现稳定的液柱,说明气密性良好。(答案合理也给分)
加药品的先后顺序:先加CuO后滴加H2O2)
(2)防止O2溶于水。
(3)生成30mL氧气所需要的时间
(4)
实验步骤 | 设计这一步骤的目的 |
把上述混合物,过滤所固体晾干后称重 | CuO的质量在反应前后是否保持不变 |
将所得固体重新与过氧化氢溶液混合,观察是否依旧能加快过氧化氢溶液的分解 | CuO的化学性质在反应前后是否保持不变 |
【解析】
试题分析:(1)检验装置一气密性的方法是在橡皮管上夹弹簧夹,向长颈漏斗内加水,至形成液封,再加适量水,静置一段时间后,若长颈漏斗液面与试管内液面差保持不变,说明气密性良好;添加药品的顺序是先固体后液体即先加CuO后滴加H2O2;
(2)氧气为溶于水,图(Ⅱ)装置中油层的作用是阻止氧气与水的接触,防止氧气O2溶于水,使实验更加准确;
(3)探究氧化铜的催化效果只需要比较在相同时间内产生的氧气的体积,若加入了氧化铜的过氧化氢溶液比没有加的分解的更快,说明氧化铜能加快过氧化氢的分解速率;
(4)判断一种物质是否是反应的催化剂,要看它是否具有催化剂的特征,即能否改变物质的反应速率、化学反应前后自身的质量化学性质是否改变。

 阅读快车系列答案
阅读快车系列答案【题目】在宏观、微观和符号之间建立联系是学习化学的基本方法。
(1)下列为A、B、C、D的原子或离子的结构示意图。
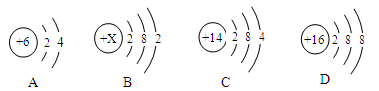
①B的原子结构示意图中X为_________;若D的元素符号为S,则D表示的微粒符号是_________。
②分析A、C的原子结构,你认为A与C具有相似化学性质的原因是__________________。
(2)下图为处理汽车尾气化学反应微观示意图,其中A、B、C、D表示4种物质,A和B在一定条件下反应可生成C 和D。
反应前 | 反应后 |
| ||
|
|
|
| |
③物质C中,各元素的质量比为_________。
④根据上述微观示意图,处理汽车尾气的化学反应方程式为_________。