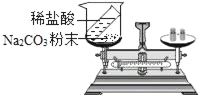
题目内容
【题目】将1.17g氯化钠固体放入烧杯中,加入51.7g水充分溶解后得到常温下氯化钠的不饱和溶液,再向所得溶液中逐滴滴入100g一定溶质质量分数的硝酸银溶液。实验过程中生成沉淀的质量与滴入硝酸银溶液的质量关系如图所示:
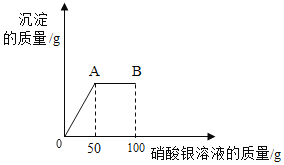
(1)B点时,溶液中所含硝酸银的质量为______。
(2)A点时,所得溶液中溶质质量分数为____。(计算结果精确到0.1%)
【答案】3.4g 1.7%
【解析】
根据题意和题中图像变化可知,氯化钠不饱和溶液加入硝酸银,氯化钠与硝酸银反应生成硝酸钠和氯化银沉淀,反应方程式为:![]() ;随着硝酸银溶液的加入,沉淀不断增加,当原溶液中氯化钠恰好反应完时,沉淀的质量达到最大,即图像中的A点,此时加入的硝酸银溶液为50g;继续加入硝酸银溶液,不再发生化学反应,至B点时,加入硝酸银溶液的总质量为100g,即反应完毕后又加入了相同的硝酸银溶液50g,因此B点时,溶液中硝酸银的质量即前50g反应过程中消耗的硝酸银质量,已知氯化钠质量,可以根据氯化钠和硝酸银反应的方程式设未知数求解;A点时,溶液的成分是硝酸钠溶液,可以根据氯化钠和硝酸银反应的方程式设未知数求出硝酸钠质量,再根据质量守恒定律,用反应前的总质量减去沉淀质量得出反应后溶液的总质量。
;随着硝酸银溶液的加入,沉淀不断增加,当原溶液中氯化钠恰好反应完时,沉淀的质量达到最大,即图像中的A点,此时加入的硝酸银溶液为50g;继续加入硝酸银溶液,不再发生化学反应,至B点时,加入硝酸银溶液的总质量为100g,即反应完毕后又加入了相同的硝酸银溶液50g,因此B点时,溶液中硝酸银的质量即前50g反应过程中消耗的硝酸银质量,已知氯化钠质量,可以根据氯化钠和硝酸银反应的方程式设未知数求解;A点时,溶液的成分是硝酸钠溶液,可以根据氯化钠和硝酸银反应的方程式设未知数求出硝酸钠质量,再根据质量守恒定律,用反应前的总质量减去沉淀质量得出反应后溶液的总质量。
解:设生成的氯化银的质量为x,生成的硝酸钠的质量为y,所消耗的硝酸银的质量为z
NaCl+AgNO3=NaNO3+AgCl↓
58.5 170 85 143.5
1.17g z y x
![]()
x=2.87g
y=1.7g
z=3.4g
(1)、由于到B点,实际又加入了50g 硝酸银溶液,所以硝酸银的质量为3.4g
(2)、A点时,所得溶液中溶质质量分数为![]() ×100%=1.7%
×100%=1.7%

 备战中考寒假系列答案
备战中考寒假系列答案【题目】将苯(C6H6)和氧气置于一个完全密闭的容器中引燃,反应生成二氧化碳、水和X.已知反应前后各物质的质量如下:
物质 | 苯 | 氧气 | 二氧化碳 | 水 | X |
反应前的质量/g | 3.9 | 9.6 | 0 | 0 | 0 |
反应后的质量/g | 0 | 0 | 6.6 | 2.7 | m |
则下列有关说法正确的是( )
A. m等于4.0
B. X由碳、氧两种元素组成
C. X由碳、氢两种元素组成
D. 生成物中二氧化碳和水的分子个数比为3:1