题目内容
某研究小组在实验室制取二氧化碳的研究中发现,通常不选用大理石与稀硫酸反应制
取二氧化碳,其原因是反应生成硫酸钙微溶物覆盖在固体的表面,阻碍了大理石与稀硫酸的接触,应逐渐减慢甚至停止。
学校实验小组设立研究课题:选择合适浓度的硫酸和适当的反应温度制取二氧化碳。
【实验一】选择合适浓度的硫酸
操作:在28℃时.用装有5mL硫酸溶液的注射器向盛有lg直径为2mm大理石的大试管中注入硫酸,
记录15分钟内生成气体的体积,见下表:
| 试管编号 | 1 | 2 | 3 | 4 | 5 |
| 硫酸浓度( %) | 15 | 20 | 25 | 30 | 35 |
| 气体体积( mL) | 35 | 47 | 55 | 51 | 42 |
【实验二】选孚合适反应温度
操作:往盛有lg直径为2mm大理石的大试管中分别加入5mL相同合适浓度而不同温度的硫酸溶液,观察反应的情况,记录如下表:
| 试管编号 | A | B | C | D | E |
| 温度 (℃) | 40 | 50 | 60 | 70 | 80 |
| 现象和比较 | 有少量气泡 | 气泡比A号试管多 | 气泡明显比B试管多 | 大量气泡产生,与常温用盐酸反应相似 | 反应激烈,迅速产生大量气体 |
请根据本次活动的研究目的,分析处理以上两个表中数据,得出结论:
问题分析:
(1)稀硫酸与大理石反应,在28℃时,选用硫酸的浓度最合适为________%,其理由是____________
____________________________________________________________________________________。
(2)当硫酸浓度一定时,反应速度与温度之间存在的关系是____________________________________
__________________________________________________________,请你从微粒的角度分析出现这种反应规律的原因可能是____________________________________________________________。
其中最合适用于实验室制取二氧化碳的反应温度为____ ℃。
(3)拓展研究:
[提出问题]影响化学反应速率还受什么因素影响?
[实验装置]如右图所示:
a.装置中红墨水的作用是____________________________________。
b.装置中长玻璃导管的作用是____________________________________。
[实验验证]
| 装置A | 装置B | |
| 长玻璃导管中现象 | ____________________________________________________ |
|
通过本实验研究中变量是:______________________________________________________,所以可以得出的结论是“_______________________________________________化学反应的速率越快”。
 |
(1)(2分,每空1分)25;高于或低于此温度产生气体量都发生减少。
(2)(3分,每空1分)温度越高,反应速率越快;
温度升高,微粒的运动速率加快,反应速率加快; 70
(3)(5分,每空1分)
便于观察实验现象; 便于进行比较(合理即给分);红墨水在长玻璃管中上升较慢;
反应物间的接触面积; 反应物间接触面积越大反应速率越快;。

 阅读快车系列答案
阅读快车系列答案(1)我们已经学习过实验室制取O2、CO2、H2(Zn和稀硫酸反应)三种气体的反应原理、制取与收集方法.请你归纳出实验室制取气体反应的共同点
①需要加热 ②使用催化剂 ③没有气体参加反应 ④原料为纯净物 ⑤只生成一种气体
(2)下列是实验室常用的仪器
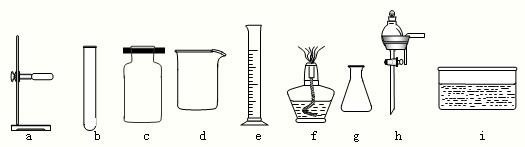
写出仪器名称:a是
(3)化学上可以通过多种反应制得NH3(极易溶于水,密度比空气小),例如
①2NH4Cl(固)+Ca(OH)2(固)
| ||
②NH4HCO3(固)
| ||
③CaO(固)+NH3.H2O(浓)═NH3↑+Ca(OH)2
我将选择反应
(4)某研究小组对用双氧水分解生成水和氧气的实验条件进行探究,完成了以下实验:
①往盛有5ml 5%H2O2溶液的试管中,伸入带火星的木条,木条不复燃.
②往盛有5ml w% H2O2溶液的试管中,加入a g MnO2,伸入带火星的木条,木条复燃.
③往盛有5ml w% H2O2溶液的试管中,加入a g Fe2O3,伸入带火星的木条,木条复燃.
④经检验,②③中反应后试管中仍分别含有a gMnO2和 ag Fe2O3
| 问题一:请你写出用双氧水和二氧化锰制氧气的化学反应方程式 问题二:MnO2和 Fe2O3在上述反应中的作用是 实验②④中的H2O2的浓度(w%)以 |
| 问题三:从左表中能得到哪些结论?(写出一条结论) |
| 浓度 时间(min) 条件 |
30%H2O2 | 15%H2O2 | 5%H2O2 |
| ag MnO2 | 0.2 | 0.8 | 2.0 |
| ag Fe2O3 | 0.7 | 9.0 | 16.0 |
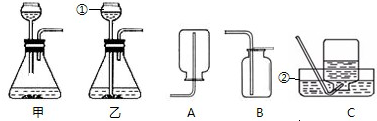
(1)标号仪器的名称为:①
(2)实验室用过氧化氢和二氧化锰制氧气,反应的化学方程式为
(3)收集氧气时,可以根据氧气的
(4)如果用B装置进行收集,需要验满,方法是:将带火星的木条伸到
(5)某研究小组对用H2O2分解的实验条件进行探究.他们进行以下试验:
①往盛有5mL 5%H2O2溶液的试管中,伸入带火星的木条,木条不复燃
②往盛有5mL w%H2O2溶液的试管中,加入a g MnO2,伸入带火星的木条,木条复燃
③往盛有5mL w%H2O2溶液的试管中,加入a g Fe2O3,伸入带火星的木条,木条复燃
④经检验,②③中反应的试管中管中仍然有a g MnO2和a g Fe2O3.
研究小组还对溶液浓度、催化剂的种类等实验条件进行了探究.下表选取了部分实验数据.用足量等体积H202溶液制取相同体积02所需的时间
| 时间 (min) 浓度 条件 |
30%H2O2 | 15%H2O2 | 5%H2O2 |
| 加入agMnO2 | 0.2 | 0.8 | 2.0 |
| 加入agFe2O3 | 7.0 | 9.0 | 16.0 |
问题:(2)实验②、③中H202的浓度(w%)以
问题:(3)从上表中能得出哪些结论?

 ⊥
⊥