题目内容
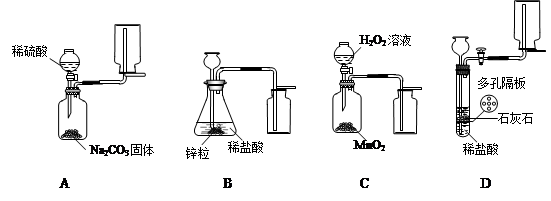
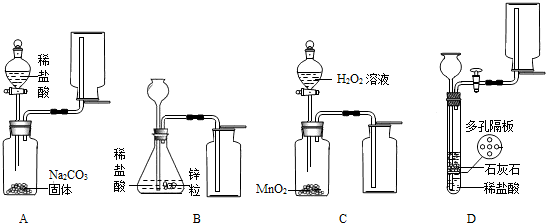
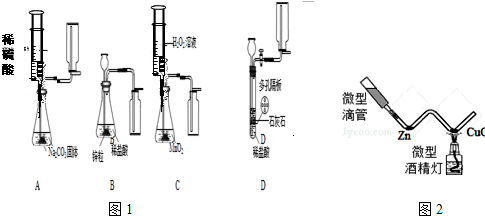
某探究小组拟在实验室用图1所示装置和药品制取气体:
 ⊥
⊥
回答下列问题:
(1)A装置中收集气体的仪器名称是
(2)能够实现气体发生和收集的正确装置是
(3)上面四套装置中哪个装置中的化学反应无法自由控制是否进行?答:
(4)某研究小组拟用装置A中的发生装置产生CO2.实验时需要溶质质量分数为9.8%的稀硫酸138g,则需要用
(5)如图2为某同学设计的氢气还原氧化铜的微型实验装置,微型滴管内装稀硫酸.
①实验时应先挤压微型滴管,还是先点燃微型酒精灯?
②写出CuO发生变化的化学方程式
 ⊥
⊥回答下列问题:
(1)A装置中收集气体的仪器名称是
集气瓶
集气瓶
.(2)能够实现气体发生和收集的正确装置是
C
C
(填装置代号).该装置中制气体的反应方程式是2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
(3)上面四套装置中哪个装置中的化学反应无法自由控制是否进行?答:
B
B
(填装置代号).(4)某研究小组拟用装置A中的发生装置产生CO2.实验时需要溶质质量分数为9.8%的稀硫酸138g,则需要用
10
10
mL量筒一次性量取溶质质量分数为98%,密度为1.84g/mL的浓硫酸7.5
7.5
mL(准确到小数点后一位),才能配制出该稀硫酸.(5)如图2为某同学设计的氢气还原氧化铜的微型实验装置,微型滴管内装稀硫酸.
①实验时应先挤压微型滴管,还是先点燃微型酒精灯?
先挤压微型滴管
先挤压微型滴管
.②写出CuO发生变化的化学方程式
H2+CuO
Cu+H2O
| ||
H2+CuO
Cu+H2O
.
| ||
分析:(1)熟练掌握常见化学仪器的名称及其用途;
(2)根据反应物的状态和反应条件选择发生装置:固体加热型和固液常温型;根据气体的密度和溶解性选择收集方法,进行组合;实验室用过氧化氢溶液和二氧化锰制取氧气,二氧化锰是催化剂,写出反应的化学方程式;
(3)要自由控制是否进行就要控制药品的接触和分离;
(4)根据提供的数据,先计算出实验时需要溶质质量分数为9.8%的稀硫酸138g中含有的硫酸的质量,再根据浓硫酸的密度计算出所需浓硫酸的体积,然后确定所用量筒;
(5)根据使用氢气作为还原剂冶炼金属的步骤和原理分析.
(2)根据反应物的状态和反应条件选择发生装置:固体加热型和固液常温型;根据气体的密度和溶解性选择收集方法,进行组合;实验室用过氧化氢溶液和二氧化锰制取氧气,二氧化锰是催化剂,写出反应的化学方程式;
(3)要自由控制是否进行就要控制药品的接触和分离;
(4)根据提供的数据,先计算出实验时需要溶质质量分数为9.8%的稀硫酸138g中含有的硫酸的质量,再根据浓硫酸的密度计算出所需浓硫酸的体积,然后确定所用量筒;
(5)根据使用氢气作为还原剂冶炼金属的步骤和原理分析.
解答:解:(1)A装置中收集气体的仪器名称是集气瓶;
(2)A中制取二氧化碳的最佳药品二氧化碳的密度比空气大,故应该采用向上排空气法收集,错误;B中氢气的密度比空气小,故应该采用向下排空气法收集,错误;C制取和收集的是氧气,发生装置和收集装置均正确,反应的方程式为:2H2O2
2H2O+O2↑;D制取的是二氧化碳,发生装置正确,但二氧化碳的密度比空气大,故应该采用向上排空气法收集,错误;
(3)要自由控制是否进行,可以通过控制液体和固体的接触实现:其中A和C可以通过注射器滴加液体的速度,D装置通过活塞控制液体与隔板上的固体的接触和分离,而B装置无法实现固液的分离,因此无法控制反应的进行;
(4)实验时需要溶质质量分数为9.8%的稀硫酸138g,其中硫酸的量是:138×9.8%=13.5g.
所以需要溶质质量分数为98%的浓硫酸:13.5÷98%=13.8g
根据公式:m=ρ?v 可知需要取溶质质量分数为98%,密度为1.84g/mL的浓硫酸:v=m/ρ=13.8g/1.84g/mL=7.5mL.所以要选用10mL的量筒.
(5)①氢气还原氧化铜的实验,实验时应先挤压微型滴管,目的是排净装置内的空气,以防加热时发生爆炸;
②H2和CuO生成Cu和H2O,反应的方程式为:H2+CuO
Cu+H2O.
故答案为:(1)集气瓶 (2)C、2H2O2
2H2O+O2↑ (3)B
(4)10、7.5 (5)①先挤压微型滴管、②H2+CuO
Cu+H2O
(2)A中制取二氧化碳的最佳药品二氧化碳的密度比空气大,故应该采用向上排空气法收集,错误;B中氢气的密度比空气小,故应该采用向下排空气法收集,错误;C制取和收集的是氧气,发生装置和收集装置均正确,反应的方程式为:2H2O2
| ||
(3)要自由控制是否进行,可以通过控制液体和固体的接触实现:其中A和C可以通过注射器滴加液体的速度,D装置通过活塞控制液体与隔板上的固体的接触和分离,而B装置无法实现固液的分离,因此无法控制反应的进行;
(4)实验时需要溶质质量分数为9.8%的稀硫酸138g,其中硫酸的量是:138×9.8%=13.5g.
所以需要溶质质量分数为98%的浓硫酸:13.5÷98%=13.8g
根据公式:m=ρ?v 可知需要取溶质质量分数为98%,密度为1.84g/mL的浓硫酸:v=m/ρ=13.8g/1.84g/mL=7.5mL.所以要选用10mL的量筒.
(5)①氢气还原氧化铜的实验,实验时应先挤压微型滴管,目的是排净装置内的空气,以防加热时发生爆炸;
②H2和CuO生成Cu和H2O,反应的方程式为:H2+CuO
| ||
故答案为:(1)集气瓶 (2)C、2H2O2
| ||
(4)10、7.5 (5)①先挤压微型滴管、②H2+CuO
| ||
点评:本题考查了常见气体发生装置和收集方法的选择、评价、性质等多方面的知识,关键是明确发生装置和收集方法选择的依据,然后根据已有的知识逐一分析.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 ⊥
⊥