题目内容
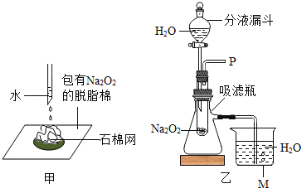
【题目】探究氯酸钾和二氧化锰制氧气实验中反应物与催化剂的最佳质量比。实验中采用如图实验装置,取20g氯酸钾,分成10等份,每份2g,分别装入10支试管中。在10支试管中分别加入不同质量的二氧化锰,分别测量二氧化锰与氯酸钾在不同质量比时,生成200mL氧气所消耗的时间。实验记录的数据如下:
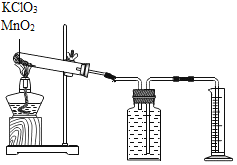
实验编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
二氧化锰质量(g) | 0.1 | 0.2 | 0.33 | 0.4 | 0.5 | 0.66 | 1 | 1.3 | 2 | 3 |
二氧化锰与氯酸钾的质量比 | 1:20 | 1:10 | 1:6 | 1:5 | 1:4 | 1:3 | 1:2 | 2:3 | 1:1 | 3:2 |
生成200mL氧气时间(秒) | 235 | 186 | 162 | 147 | 133 | 117 | 143 | 160 | 211 | 244 |
请回答下列问题:
(1)实验中收集一定体积的氧气采用的实验方法利用了氧气_____的性质。收集气体前集气瓶内未装满水,对实验结果_____(填“有”或“没有”)影响。
(2)分析上述数据,你认为利用此法制氧气时,二氧化锰与氯酸钾的最佳质量比为_____。
(3)利用双氧水和二氧化锰的混合物制氧气比加热氯酸钾和二氧化锰混合物制氧气更好。请写出前者的两个优点:①_____;②_____。
【答案】不易溶于水 没有 1:3 不需要加热 产物不污染环境
【解析】
(1)实验中收集一定体积的氧气采用的实验方法利用了氧气不易溶于水的性质;
收集气体前集气瓶内未装满水,对实验结果没有影响,这是因为有多少体积的氧气进入集气瓶,就有多少体积的水进入量筒中.
故填:不易溶于水;没有.
(2)利用此法制氧气时,二氧化锰与氯酸钾的最佳质量比为1:3时,生成200mL氧气所消耗的时间最短.
故填:1:3.
(3)前者的两个优点:不需要加热,产物不污染环境.
故填:不需要加热;产物不污染环境.

【题目】同学们在学习金属的化学性质时,做了稀盐酸、稀硫酸分别与锌、铜反应的实验,实验结束后,对酸的性质很感兴趣,于是又继续研究稀硝酸(![]() )的性质,在老师的带领下进行了以下实验探究。
)的性质,在老师的带领下进行了以下实验探究。
(实验探究)
实验内容 | 实验现象 | 结论与分析 |
(1)用玻璃棒蘸取稀硝酸滴到pH试纸上,与________比较,读出pH。 | pH试纸变红色 | pH=1,稀硝酸显________性 |
(2)取少量氢氧化钠溶液于试管中,滴入几滴酚碱溶液,再逐滴加入稀硝酸,振荡。 | 溶液的颜色变化情况是_______ | 稀硝酸与氢氧化钠发生了中和反应。反应的化学方程式_______ |
(3)再分别在盛有少量锌粉、铜粉的试管中加入2mL的稀硝酸,观察实验现象。 | 在两支试管的溶液中均冒出气泡,产生无色气体A,在试管口气体A变成红棕色有刺激性气味的气体B | 锌、铜都能与稀硝酸反应,产生气体A |
(提出疑问):无色气体A是什么?
(查阅资料)含氮元素的某些气态物质的物理性质:
|
|
|
| |
颜色 | 无色 | 无色 | 无色 | 红棕色 |
溶解性 | 极易溶于水 | 难溶于水 | 可溶于水或硝酸 |
(交流与拓展)通过分析资料,大家一致认同了红棕色气体B是![]() ,但对无色气体A及其变化的原因有不同的看法。
,但对无色气体A及其变化的原因有不同的看法。
①小南同学认为A不可能是![]() ,他的理由是________。
,他的理由是________。
②小宁同学认为A是![]() ,却遭到大家的一致反对,原因是________。
,却遭到大家的一致反对,原因是________。
(实验结论)经讨论,最终一致认为A是![]() ,
,![]() 在试管口遇氧气生成了
在试管口遇氧气生成了![]() 。
。
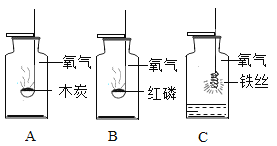
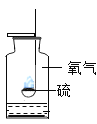
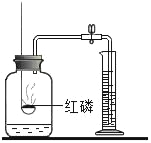
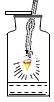
【题目】对下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
实 验 装 置 |
硫在氧气中燃烧 |
测定空气中氧气含量 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
解释 | 集气瓶中的水: 吸收放出的热量 | 集气瓶中的水: 更快地吸收白烟 | 量筒中的水: 通过水体积的变化得出氧气体积 | 集气瓶中的水: 冷却溅落融熔物,防止集气瓶炸裂 |
A | B | C | D |
A. AB. BC. CD. D