题目内容
为了测定某铜锌合金(即铜锌混合物)中锌的质量分数,某同学利用该合金与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下(实验中的误差忽略不计):
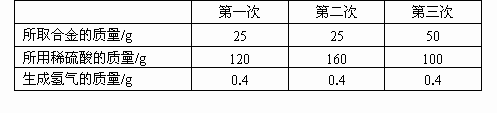
(1)试计算该铜锌合金中锌的质量分数.
(2)从上表数据分析,当所取合金与所用的稀硫酸的质量比为________时,表示合金中的锌与稀硫酸中的硫酸恰好完全反应.
答案:
解析:
解析:
|
(1)由“第一次”与“第二次”实验数据分析,合金均为25g,增加稀硫酸的质量时,产生氢气的质量均为0.4g,表明此时硫酸足量而合金中的锌完全反应,因此可用产生氢气的质量0.4g,求出25g合金中所含锌的质量. Zn+H2SO4=ZnSO4+H2↑ 65g 2g x 0.4g x=65g×0.4g/2g=13g 故该铜锌合金中锌的质量分数为: 13g/25g×100%=52% 答:该铜锌合金中锌的质量分数为52%. (2)1∶4 |

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:
(1)写出有关反应的化学方程式;
(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为 时,表明合金中的锌与稀硫酸恰好完全反应.(提示:铜与稀硫酸不反应)
(3)试计算该铜锌合金中锌的质量分数.
(4)计算当所用合金与稀硫酸恰好完全反应时,所得溶液中溶质的质量分数.
| 第一次 | 第二次 | 第三次 | |
| 所取合金的质量/g | 10 | 10 | 20 |
| 所用稀硫酸的质量/g | 50 | 80 | 50 |
| 生成氢气的质量/g | 0.2 | 0.2 | 0.2 |
(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为
(3)试计算该铜锌合金中锌的质量分数.
(4)计算当所用合金与稀硫酸恰好完全反应时,所得溶液中溶质的质量分数.
为了测定某铜锌合金中锌的质量分数,某同学利用一定量的该合金与稀硫酸反应,进行了三次实验,相关的实验数据记录如下表.
(1)计算该铜锌合金中锌的质量分数.
(2)计算所用稀硫酸中溶质的质量分数.(结果精确到0.1%)
(可能用到的相对原子质量H-1 O-16 S-32 Cu-64 Zn-65)
| 实验 物质用量 |
第一次 | 第二次 | 第三次 |
| 所取合金的质量/g | 10 | 10 | 10 |
| 所用稀硫酸的质量/g | 50 | 100 | 150 |
| 剩余固体质量/g | 3.5 | 3.0 | 3.0 |
(2)计算所用稀硫酸中溶质的质量分数.(结果精确到0.1%)
(可能用到的相对原子质量H-1 O-16 S-32 Cu-64 Zn-65)
为了测定某铜锌合金中铜的质量分数,取合金样品跟稀盐酸反应.三次实验的有关数据如下表:
(1)根据上表中的数据分析,当铜锌合金中的锌与稀盐酸中的HCl恰好完全反应时,合金样品的质量与稀盐酸的质量之比为 .
(2)计算该铜锌合金中铜的质量分数. .
| 实验编号 | 所需合格样品的质量/g | 所取稀盐酸的质量/g | 生成氢气的质量/g |
| 1 | 10.0 | 40.0 | 0.1 |
| 2 | 10.0 | 50.0 | 0.1 |
| 3 | 20.0 | 36.5 | 0.1 |
(2)计算该铜锌合金中铜的质量分数.
 (2013?浦口区一模)Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.
(2013?浦口区一模)Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.