题目内容
【题目】根据下列几幅图回答问题。

(1)图1中a导管口产生的气体是_______,该实验说明水是由______________组成。
(2)图2中根据火柴梗在火焰不同部位被烧的情况,推测蜡烛火焰温度最高的是______;取一个冷而干燥的小烧杯罩在火焰上方,根据烧杯内壁观察到的现象,推测蜡烛燃烧后的一种生成物是______;用火柴去点蜡烛刚熄灭是产生的白烟,蜡烛______(填“能”或“否”)重新燃烧。
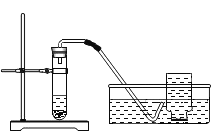
(3)图3是实验室制取蒸馏水的简易装置,烧瓶内加入几块沸石的作用是__________。
【答案】H2 氢元素和氧元素 外焰 水(H2O) 能 防止暴沸
【解析】
(1)图1为电解水实验,与电源负极相连的导管产生氢气,a导管口产生的气体是![]() ,与电源正极相连的导管产生
,与电源正极相连的导管产生![]() ,b导管口产生的气体是氧气,该实验说明水是由氢元素和氧元素组成的。
,b导管口产生的气体是氧气,该实验说明水是由氢元素和氧元素组成的。
(2)图2实验中根据火柴梗在火焰不同部位被烧的情况,推测蜡烛火焰温度最高的是外焰;取一个冷而干燥的小烧杯罩在火焰上方,烧杯内壁出现小水珠,推测蜡烛燃烧后的一种生成物是水;用火柴去点蜡烛刚熄灭是产生的白烟,蜡烛能重新燃烧。
(3)图3是实验室制取蒸馏水的简易装置,烧瓶内加入几块沸石的作用是防止暴沸。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某金属冶炼场在生产过程中产生了一些含铜废料。化学兴趣小组利用稀硫酸和铁粉分离回收铜,并得到硫酸亚铁晶体。

(查阅资料)
(1)在同温同压下相同体积的气体含有的分子个数相同;
(2)在通入空气和加热的条件下,铜可以和稀硫酸反应生成硫酸铜,反应的化学方程式是2Cu +2H2SO4+ O2 ![]() 2CuSO4 + 2H2O 。
2CuSO4 + 2H2O 。
(回答问题)
(1)步骤I中分离得到固体A和蓝色溶液B的操作名称是_____;
(2)蓝色溶液B的溶质是_____(填化学式);
(3)写出反应Ⅲ中发生反应的化学方程式_____;
(4)铜制品可以在空气中发生锈蚀,铜锈化学式为Cu2(OH)2CO3,根据铜锈的化学式可以判断铜锈蚀需要空气中的_____(写化学式)。
(拓展研究)
小明通过查阅资料,利用铁粉、碳粉、氯化钠等物质进行了实验(如装置图),9分钟后测得数据如下表:

实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 量气管内液面所在刻度 | 量气管内液面所在刻度 |
150.0mL | 30.8mL | 0.2mL |
(1)请计算出空气中的氧气含量_____;
(2)碳粉和氯化钠在本实验中的作用是_____;
(3)若将装置中的粗铁粉换成足量的铜粉进行实验,请判断能否比较准确的测定出空气中氧气的体积分数,请说明理由_____。
【题目】某化学兴趣小组对“空气中氧气含量的测定”展开探究。
(实验回顾)实验室常用红磷燃烧的方法测定空气中氧气的含量(如图1、图2),红磷燃烧的符号表达式为__________。兴趣小组用该方法测出的氧气含量常常远低于21%。
(实验改进)甲同学认为误差主要是由实验装置造成的,于是改用图3装置进行实验。
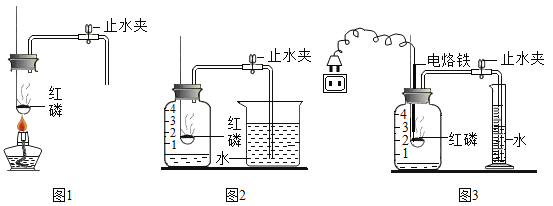
(1)按图2装置实验,实验开始前应先进行的一步操作是________________。实验中燃烧匙内盛放红磷的量必须_________。
(2)按图3装置实验,点燃红磷的方式不同于图1,而是接通电源使电烙铁发热,点燃红磷后,断开电源。与图2装置相比,图3装置使用电烙铁可以减小实验误差,其原因是____________。
(提出问题)在操作规范的情况下,用改进后的装置测得的氧气含量约为14%。为什么测量结果与真实值仍有较大差距呢?
(查阅资料)燃烧过程中当氧气体积分数低于7%时,红磷就无法继续燃烧。引起本实验的误差除装置外,还与可燃物的性质有关。
(实验探究1)乙同学利用图4装置测定空气中氧气的含量。其中与集气瓶相连的压强传感器等电子设备能将集气瓶内压强精确地记录并保存下来。图5是用该装置测得的木炭在集气瓶中燃烧的压强-时间关系图(该装置气密性良好,P0是集气瓶内初始气压,P是反应结束时恢复到室温时集气瓶内的气压)。
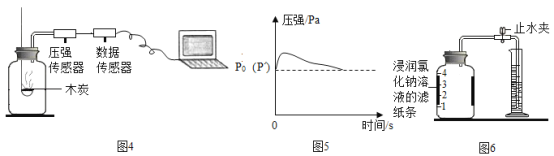
(3)反应开始时集气瓶中压强会瞬间_____(填“变大”、“变小”或“不变”),原因是___________ 。
(4)根据图5,木炭不可代替红磷测定空气中氧气含量的原因是______________。
(实验探究2)已知常温下铁与空气中的氧气、水反应生成铁锈(主要成分是Fe2O3),在有氯化钠、炭粉存在条件下,反应速度较快。丙同学根据铁生锈的原理,探究用铁能否准确测定空气中氧气的含量,设计了图6所示实验装置,8分钟后测得数据如下表:
A | 实验后的体积 | |
集气瓶内空气 | 量筒内水 | 量筒内剩余水 |
262mL | 180.0mL | 127.2mL |
(5)丙同学将铁粉、炭粉等物质不是堆在瓶底,而是撒在浸润氯化钠的滤纸条上再贴在广口瓶内侧,其目的是____________________。
(6)根据表中数据计算空气中的氧气含量____________。(写出计算过程,计算结果保留到0.1%)
(结论与反思)通过上述实验探究,选择合适的物质和实验装置进行实验,可较为快速地完成实验并减小实验误差。
【题目】某兴趣小组在制取氧气的实验过程中,有如下实验设计方案,该方案的实验目的是:探究_______________________对反应速率的影响.
编号 | 温度 | 催化剂 | 氯酸钾、二氧化锰的质量比 | 生成1升氧气所需时间/s |
实验Ⅰ | 400℃ | MnO2 | 1:1 | 153 |
实验Ⅱ | 400℃ | MnO2 | 2:1 | 240 |
小林在实验时,联想到了渔民用过氧化钙(CaO2)增加鱼池中的含氧量,提出猜想Ⅱ.
【猜想Ⅱ】过氧化钙与水反应可制取氧气.
实验装置 | 实验主要过程 |
| ①检查装置气密性. ②加入过氧化钙和水后,有少量细小气泡缓慢放出,在导管口几乎收集不到气体.该装置放置到第二天,集气瓶中只收集到极少量气体,震荡试管后仍有少量细小气泡缓慢放出. |
实验结论:过氧化钙与水反应______(填“能”或“不能”)用于实验室制取氧气.
【分析与反思】
(1)过氧化钙与水反应虽然没有快速收集到大量氧气,但由此实验现象,小林认为渔民用过氧化钙做增氧剂的主要原因是__________________.
(2)小林希望对此实验进行改进,使该反应加快,请你帮他提出合理化建议___________.
(3)同学们对过氧化钙与水反应的生成物猜想如下:①氢氧化钙和氧气②碳酸钙和氧气
你认为猜想_____(填序号)一定是错误的,理由是________________________.
【计算】该兴趣小组的同学们购得用于增氧的过氧化钙产品(杂质不含钙元素),标签如图所示.试计算:

(1)过氧化钙的相对分子质量为_______;
(2)过氧化钙中钙元素与氧元素的质量比为________;
(3)____________g过氧化钙与100g碳酸钙CaCO3含钙量相当;