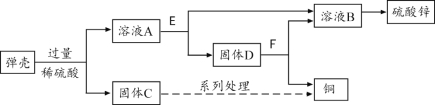
题目内容
【题目】(6分)“对比实验”是化学学习中行之有效的思维方法。请回答下列问题。
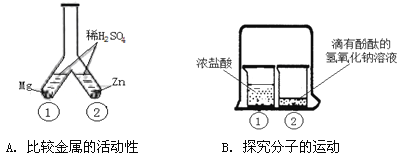
(1)实验A:观察到A中_____________(填“”或“)反应更剧烈,可知金属Mg比Zn更活泼。
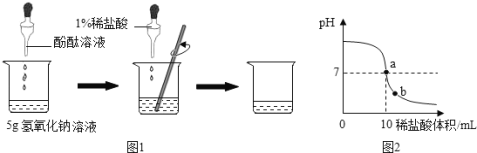
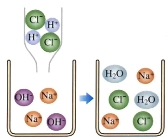
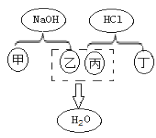
(2)实验B:烧杯中溶液颜色变化能说明分子不断运动。一段时间后,观察到的主要现象是___________;下图可表示该现象对应反应的微观实质,且甲、乙、丙、丁分别表示NaOH、HCl溶液中的四种离子,乙与丙结合为水的表达式为__________________________________。
【答案】(1)实验A:观察到A中(填“”或“)反应更剧烈
(2)经过一段时间后烧杯溶液变成无色
(3)H++OH-=H2O
【解析】
试题分析:(1)比较金属的活动性可根据金属与酸反应的剧烈程度来判断,该实验中镁与硫酸反应更剧烈,说明镁的活动性比锌强;
(2)由于分子在不断的运动,盐酸中的氯化氢气体会进入到氢氧化钠溶液中形成盐酸,盐酸会与氢氧化钠溶液发生中和反应,故一段时间后烧杯2中的溶液会由红色变成无色;氢氧化钠是由钠离子和氢氧根离子构成的,盐酸是由氢离子和氯离子构成的,中和反应的实质是氢氧根离子和氢离子结合生成水的过程:H++OH-====H2O 。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目