题目内容
【题目】小明为研究金属X、Zn、Fe、Cu的活动性顺序,做了如下实验:
(1)将金属X分别放入ZnSO4、FeSO4、CuSO4的溶液中,反应后有无金属析出的情况如下表所示:
溶液种类 | ZnSO4 | FeSO4 | CuSO4 |
加入X后有无金属析出 | 无 | 无 | 有 |
则金属X、Cu和Fe的活动性顺序由强到弱排列为_____。
(2)小明继续研究Zn和Fe的活动性强弱,将质量相等的颗粒大小相同的金属Zn和Fe放在少量的相同体积的同种稀盐酸中,如图所示,若出现_____的现象,则Zn的活动性比Fe强;
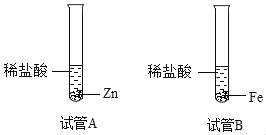
(3)小军通过将Fe放入CuSO4溶液反应,也可比较出Cu和Fe的活动性强弱,请写出Fe和CuSO4的化学方程式_____。
【答案】Fe>X>Cu 锌反应的速率比铁快 Fe+CuSO4=FeSO4+Cu
【解析】
根据金属与盐的反应可以比较金属的活动性强弱;金属与酸反应的剧烈程度判断金属的活动性;铁与硫酸铜的反应写出反应的化学方程式。
(1)由反应的现象可知,X与FeSO4不反应,能与CuSO4反应,可以比较出金属X、Cu和Fe的活动性顺序由强到弱排列为:Fe>X>Cu;故填:Fe>X>Cu
(2)根据金属与酸反应的剧烈程度可以比较出金属的活动性强弱,所以将质量相等的颗粒大小相同的金属Zn和Fe放在少量的相同体积的同种稀盐酸中,若出现锌反应的速率比铁快的现象,则Zn的活动性比Fe强;故填:锌反应的速率比铁快
(3)Fe和CuSO4反应生成了硫酸亚铁和铜,反应的化学方程式是:Fe+CuSO4=FeSO4+Cu。故填:Fe+CuSO4=FeSO4+Cu

练习册系列答案
相关题目