题目内容
【题目】.为了探究木炭在高温条件下还原氧化铜所生成的气体产物是什么,课外兴趣小组进行了如下实验探究:
【提出问题】生成的气体产物是什么?
【实验猜想】猜想1:只有CO2; 猜想2:只有___________(填化学式);
猜想3:含有CO和CO2。
若猜想1成立,木炭与氧化铜反应的化学方程式为___________________________。
【实验探究】基于猜想3,根据CO和CO2的性质,兴趣小组同学设计了下图装置进行探究。(提示:NaOH溶液能吸收CO2)
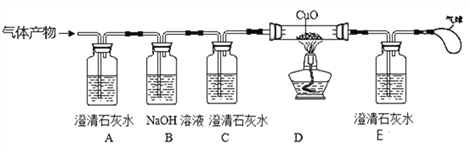
(1)观察到A装置中的澄清石灰水变浑浊,证明气体产物中有CO2,A装置中的化学方程式是_____________________________。
(2)有两种实验现象都能分别证明气体产物中含有CO。
现象1:C装置中澄清石灰水____________________,E装置中出现浑浊的现象。
现象2:D装置中出现______________________________的现象。
(3)C装置的作用是________________________________________________________。
【实验结论】通过实验探究,猜想3成立。
【答案】 CO C +2CuO![]() 2Cu + CO2 ↑ CO2 + Ca(OH)2==CaCO3 ↓ + H2O 无变化 黑色变红色 确定气体产物中的CO2是否被NaOH溶液完全吸收
2Cu + CO2 ↑ CO2 + Ca(OH)2==CaCO3 ↓ + H2O 无变化 黑色变红色 确定气体产物中的CO2是否被NaOH溶液完全吸收
【解析】本题通过木炭在高温条件下还原氧化铜所生成的气体产物成分探究,考查了质量守恒定律,CO2、CO检验,化学方程式的书写。
实验猜想:根据质量守恒定律可知,猜想1:只有CO2;猜想2:只有CO;猜想3:含有CO和CO2;若猜想1成立,木炭与氧化铜在高温的条件下生成铜和二氧化碳,化学方程式是:C +2CuO![]() 2Cu + CO2 ↑;
2Cu + CO2 ↑;
实验探究:(1)观察到A装置中的澄清石灰水变浑浊,证明气体产物中有CO2,A装置中二氧化碳与氢氧化钙反应生成碳酸钙白色沉淀和水,化学方程式是CO2 + Ca(OH)2==CaCO3 ↓ + H2O;
(2)若实验探究过程中生成了二氧化碳,能证明气体产物中含有CO,所以C装置中澄清石灰水不浑浊(或无明显变化),E装置中出现浑浊的现象,能证明气体产物中含有CO;若氧化铜能被还原成铜也能证明气体产物中含有CO,所以D装置中出现固体从黑色变红色的现象,能证明气体产物中含有CO;(3)气体产物中的二氧化碳对实验探究中的生成物的检验有干扰,所以先要完全除去。 C装置的作用是:确定气体产物中的CO2是否被NaOH溶液完全吸收。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案【题目】下列实验方法一定能达到实验目的的是
选项 | 实验目的 | 实验方法 |
A | 检验一瓶气体是否为 | 将燃着的木条伸入瓶中 |
B | 鉴别 | 分别点燃,在火焰上方罩一干冷烧杯 |
C | 鉴别石灰水和 | 加入适量的稀盐酸 |
D | 比较Zn、Cu、Ag的金属活动性 | 将Zn和Ag分别放入 |