题目内容
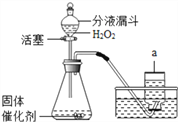
【题目】实验室里既可用高锰酸钾(或氯酸钾和二氧化锰的混合物)在加热条件下使其分解制取氧气,也可用如图装置,通过分解过氧化氢(H2O2)来制取氧气。
请你根据已学化学知识和经验回答下列问题:
(1)写出过氧化氢分解制氧气的化学方程式:_______________。
(2)写出如图装置中仪器a的名称:__________ 。
(3)与高锰酸钾(或氯酸钾和二氧化锰的混合物)制取氧气相比,用过氧化氢制取氧气的优点是:__________________。
(4)收集氧气的方法还可用_______________法,你选择此方法的理由是:_____________。
(5)如用如图所给的发生装置还可以制取的气体有_________________。
(6)如图发生装置中用分液漏斗而不用长颈漏斗的优点是:_______________。
【答案】 略 略 略 略 略 略 略
【解析】(1)过氧化氢制氧气的反应物是过氧化氢,生成物是水和氧气,反应条件是二氧化锰作催化剂,用观察法配平,氧气后面标上上升符号,化学方程式为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(2)要熟记常见仪器的名称,用来收集气体的是集气瓶;
(3)高锰酸钾制氧气需要加热,操作复杂,不安全,而过氧化氢制氧气不需加热,操作简单,安全;
(4)收集方法的选择是根据:氧气不易溶于水或不易溶于水用排水法收集,密度比空气大用向上排空气法收集,密度比空气小用向下排空气法收集,由于氧气密度比空气大,用向上排空气法收集;
(5)反应物的状态是固体和液体,不需要加热,如果固体与固体反应制取气体需要加热,由于制取二氧化碳是盐酸和大理石,也不需要加热,故可制取二氧化碳;
(6)分液漏斗可以利用活塞控制滴液的快慢,节约药品,便于控制反应,A中装置中用分液漏斗不用长颈漏斗目的是控制反应速率。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】实验研究是化学学习的重要方法。请以碳及其化合物的知识进行以下实验研究。
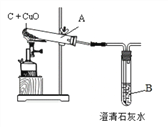
实验一:木炭还原氧化铜。
①观察到B中溶液变浑浊,试管A中的现象_______________,
A中反应的化学方程式为________,还原剂是__________。
②反应完全后,若先撤走酒精喷灯停止加热,可能导致的后果___________________________
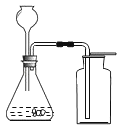
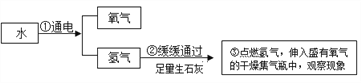
实验二:为了探究某混合气体是由水蒸气、一氧化碳、二氧化碳3种气体组成, 设计了如下实验:
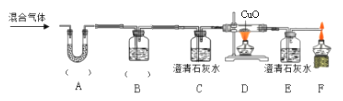
①欲探究混合气体中含有CO2和H2O蒸气,在图中的A、B装置内依次盛放的化学试剂为_______;检验出水蒸气的现象是_____________,反应的化学方程式为__________。
②装置E、F的作用分别是__________________ 、_____________________,E中反应的化学方程式为_____________。
③若没有装置E_______________(填“能”或“否”)证明混合气体中含有一氧化碳,请简述理由_____________________。
④实验结束后先熄灭装置D处的酒精灯,E中石灰水不会倒流的原因是____________。
⑤该实验中体现的一氧化碳的化学性质有__________________________。
实验三:有些化妆品中添加的高纯度碳酸钙可以用石灰石来制备,如下图。(假设石灰石中除碳酸钙外。所含杂质仅为SiO2,其不溶于水,高温不会分解,也不与盐酸反应)
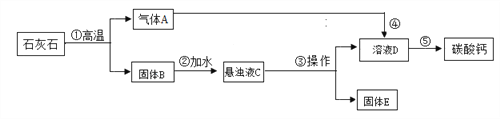
Ⅰ. 写出步骤①②中反应的化学方程式____________、____________。
Ⅱ. 气体A能使紫色石蕊试液变红色,反应的化学方程式为____________ 。
Ⅲ. 操作⑤的目的是________,用到的仪器主要有玻璃棒、酒精灯、铁架台(带铁圈)、__________。
Ⅳ. 为验证实验结束后得到的固体B中碳酸钙是否已经完全分解,请设计两种方案完成下表内容。
实验步骤 | 实验现象 | 结论 | |
方案一(66) | ________________ | ________________ | ________________ |
方案二(67) | ________________ | ________________ | ________________ |
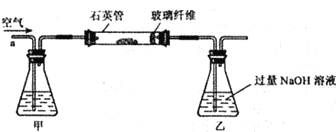
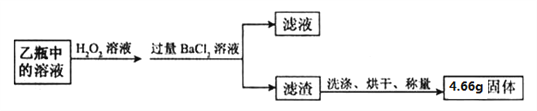
【题目】石灰石进行煅烧实验,过程如下(假设杂质不发生变化)。
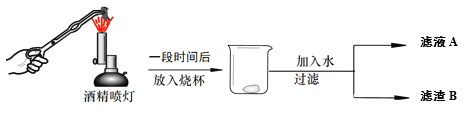
① 煅烧石灰石的化学方程式为____________________;
② 利用滤液A或滤渣B设计方案证明石灰石分解情况。
实验操作 | 判断依据 | 结论 |
_________ | __________ | 石灰石已分解 |
________ | ___________ | 石灰石完全分解 |