题目内容
【题目】向质量为m的20%的氢氧化钠溶液中逐滴加入硫酸镁溶液,至恰好完全反应时,滤去沉淀,称量所得滤液总质量为3m.
(1)计算所加硫酸镁溶液中溶质的质量分数(最后结果精确到0.1%);
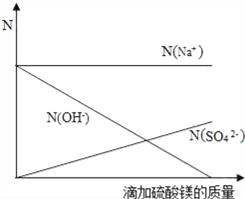
(2)用N表示溶液中离子的数目,不同种离子用离子符号注明[如N (Na+)表示钠离子的数目],请建立坐标系,绘制上述滴加过程中各种离子的数目随溶液的不断加入而变化的关系图.
【答案】(1) 14.0%;
(2)

【解析】(1)设参加反应的硫酸镁的质量为x,生成氢氧化镁的质量为y
2NaOH + MgSO4=Mg(OH)2![]() +Na2SO4
+Na2SO4
80 120 58
m![]() x y
x y
![]() =
=![]()
x=0.3m,y=0.145m
硫酸镁溶液的总质量为0.145m+3m-m=2.145m
硫酸镁溶液中溶质的质量分数为![]() 14.0%
14.0%
(2)由方程式2NaOH + MgSO4=Mg(OH)2![]() +Na2SO4可知,溶液中钠离子的个数不会改变,而随着硫酸镁的增加硫酸根离子会不断的增加,溶液中的氢氧根离子随着硫酸镁的增加不断减少,直至最终完全反应时完全消失,故变化关系图为
+Na2SO4可知,溶液中钠离子的个数不会改变,而随着硫酸镁的增加硫酸根离子会不断的增加,溶液中的氢氧根离子随着硫酸镁的增加不断减少,直至最终完全反应时完全消失,故变化关系图为


练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目