��Ŀ����
����Ŀ�������غ㶨����һ����Ҫ���ɣ������øù��ɵ����֪ʶ�ش��������⡣
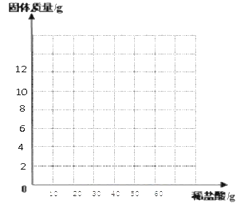
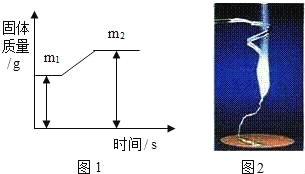
��1��þ���ڿ�����ȫȼ�պ���������þ��ֻ���������μӷ�Ӧ����ͬ������ѧ����ʽΪ_____�������������仯��ͼ1��ʾ����m2��m1֮���ʾ_____��������
��2��ʵ������У�þ����ȼ��ʵ��������ͼ2��ʾ��þ����ȫȼ�պ�����֪ʯ���������¹������������ȷ�Ӧǰþ�����ᣬ��ԭ�������_____��
��3����ʹ��ʵ����������غ㶨�ɣ���Ӧ����ʵ����_____�����н��С�
���𰸡�2Mg+O2![]() 2MgO �μӷ�Ӧ������ ����������ɢ�ݵ������� �ܱ�����
2MgO �μӷ�Ӧ������ ����������ɢ�ݵ������� �ܱ�����
��������
��1��þ��������ȼ��Ӧ��������þ���ʷ�Ӧ�Ļ�ѧ����ʽдΪ��2Mg+O2![]() 2MgO��
2MgO��
��ͼ��֪��m1��þ����������m2�Ƿ�Ӧ����������þ�����������������غ㶨�ɿ�֪��m2��m1֮����Dzμӷ�Ӧ����������������μӷ�Ӧ��������
��2��þ��ȼ��ʱ�������̣���������þ�������ɢ��������ʹʣ����������������٣������������ɢ�ݵ���������
��3��ͨ��ʵ����֤�����غ㶨��ʱ��Ϊ��֤װ�������ʵ����������䣬ʵ��Ӧ�����ܱ������н��У������ܱ�������

 ��ѧȫ��������ѵ��ϵ�д�
��ѧȫ��������ѵ��ϵ�д�����Ŀ����1����ͭ��___________���Cu-Ag����Cu-Zn�����ĺϽ�
��2��С���С�ܶԻ�ͭ�ijɷֲ�����Ȥ�����������Ի�ͭ�е�ͭԪ�غ������вⶨ̽����
С���ȡ10g��ͭ��Ʒ����ȡ60g��������Ϊ14.6%��ϡ����ƽ���ֳ����ȷݣ��ֱ���뵽ʢ�л�ͭ���ձ��У���С�ܹ۲쵽������ð��ʱ��¼�����±������ݣ�
���� | 1 | 2 | 3 | 4 | 5 | 6 |
��ϡ����������g�� | 10 | 20 | 30 | 40 | 50 | 60 |
�ձ��й���������g�� | 8.7 | 7.4 | 6.1 | 4.8 | 3.5 | 3.5 |
��ش��������⣺
�ٵ���Ӧ��������ð��ʱ�������ĵ�ϡ������____________g��
����������Ϊ����_______ g����д��������̣�
�ۻ�ͭ��ͭԪ�ص�����������_________________��
�ܻ�����ͭ�����������ϡ����ı仯��ϵͼ:____________