题目内容
【题目】(1)黄铜是___________(填“Cu-Ag”或“Cu-Zn”)的合金。
(2)小桦和小杰对黄铜的成分产生兴趣,他俩决定对黄铜中的铜元素含量进行测定探究:
小桦称取10g黄铜样品,量取60g质量分数为14.6%的稀盐酸平均分成六等份,分别加入到盛有黄铜的烧杯中,当小杰观察到无气泡冒出时记录了以下表格数据:
次数 | 1 | 2 | 3 | 4 | 5 | 6 |
加稀盐酸质量(g) | 10 | 20 | 30 | 40 | 50 | 60 |
烧杯中固体质量(g) | 8.7 | 7.4 | 6.1 | 4.8 | 3.5 | 3.5 |
请回答下列问题:
①当反应到无气泡冒出时,所消耗的稀盐酸是____________g。
②生成氢气为多少_______ g?(写出计算过程)
③黄铜中铜元素的质量分数是_________________。
④画出黄铜的质量随加入稀盐酸的变化关系图:____________
【答案】Cu-Zn 50 0.2 g 35% 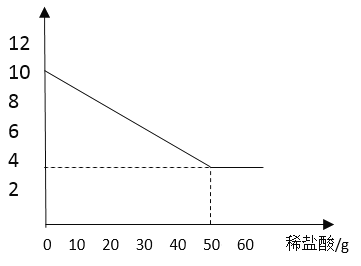
【解析】
(1)黄铜是铜和锌的合金;
(2)分析表中数据可知,第5次和第6次剩余的固体都是3.5g,即黄铜中铜的质量为3.5g,说明第5次实验时不再产生气体,所以消耗的稀盐酸质量是50g;根据质量守恒定律可知,参加反应锌的质量=10g-3.5g=6.5g;设生成氢气的质量为x,则:
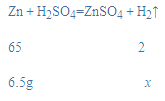
![]()
x=0.2g,
黄铜中铜元素的质量分数=![]()
![]() 100%=35%;
100%=35%;
黄铜的质量随着盐酸的不断加入,直到不再产生气泡,剩余的质量为3.5g,此时消耗的盐酸的质量为50g,据此画出示意图即可。

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目