题目内容
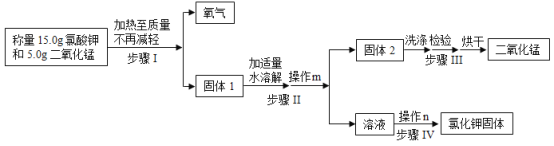
【题目】某兴趣小组用下图所示流程制取氧气并回收提纯氯化钾和二氧化锰
回答下列问题
(1)请写出步骤Ⅰ中发生的化学反应方程式:_________
(2)氯酸钾中氯元素的化合价是多少_________
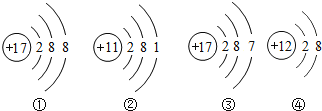
(3)如图是氯元素的原子结构示意图,下列有关叙述正确的是_________
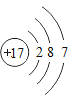
A氯原子核内有17个中子
B 氯原子第一电子层有7个电子
C氯原子在化学反应中易失去电子
D氯与铝形成物质的化学式为AlCl3
(4)操作m和n中都要用到的玻璃仪器名称是_________它在操作n中的作用是_________
(5)步骤Ⅲ中用硝酸银溶液检验洗出液中是否含有氯化钾,该检验方法的原理是_________(用化学反应方程式表示),该反应的基本类型是_________
(6)试验结束后,称得回收到氯化钾的质量比理论值小,可能的原因是_____
【答案】2KClO3![]() 2KCl+3O2↑ +5 D 玻璃棒 搅拌防止液体受热不均 AgNO3+KCl=AgCl↓+KNO3 复分解反应 固体没有完全溶解
2KCl+3O2↑ +5 D 玻璃棒 搅拌防止液体受热不均 AgNO3+KCl=AgCl↓+KNO3 复分解反应 固体没有完全溶解
【解析】
(1)氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,化学方程式为:2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
(2)氯酸钾的化学式为KClO3,设氯酸钾中氯元素的化合价为x,则(+1)+x+(-2)×3=0,x=+5,所以在氯酸钾中,氯元素的化合价是+5价;
(3)A、根据氯元素的原子结构示意图(圆圈内的数值为质子数)可知该元素的质子数是17,而不是中子数,故A错误;
B、根据氯元素的原子结构示意图(圆圈内的数值为质子数)可知该元素的第一层的电子数是2,故B错误;
C、由于氯原子的最外层电子数是7,所以化学反应中易得到1个电子,而达到稳定结构并形成阴离子,故C错误;
D、根据原子结构示意图的特点:氯元素的最外层电子数7,故化合价为-1价,铝的化合价为+3价,所以氯化铝的化学式是AlCl3,故D正确;
(4)过滤可以将不溶性固体除去,蒸发可以使溶液的溶质析出,所以操作m是过滤,操作n是蒸发,过滤与蒸发操作都会使用玻璃棒,其作用分别是引流与搅拌防止液体受热不均;
(5)氯化钾和硝酸银反应生成氯化银沉淀和硝酸钾,化学方程式为:AgNO3+KCl=AgCl↓+KNO3,该反应属于复分解反应;
(6)固体没有完全溶解、蒸发时由液体溅出等都会使回收的氯化钾质量减少。