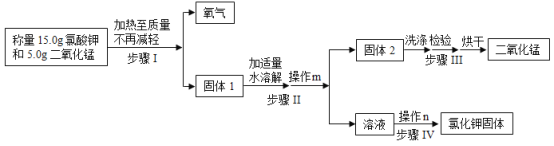
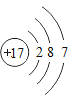题目内容
【题目】归纳总结是学习知识的重要方法。小军同学用图1总结了NaOH的四条化学性质。
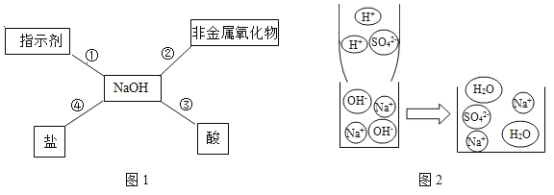
(1)验证反应①:将紫色石蕊溶液滴入NaOH溶液中,溶液会变成_________色。
(2)图2利用微观示意图来说明反应③的发生,请写出该反应的化学方程式:_______;从该图还可以看出,反应后的溶液pH_________7(填“>”、“=”或“<”)。
(3)如果反应④能够发生,你选择的物质是________(填序号)。
A HCl B Na2CO3 C CuSO4
(4)另外,NaOH溶液还能与某些金属(如Al)发生反应。请配平该反应的化学方程式:_____NaOH + _____H2O + _____Al= _____NaAlO2 + _____H2↑。
【答案】蓝 ![]() = C 2 2 2 2 3
= C 2 2 2 2 3
【解析】
(1)NaOH属于碱,溶液呈碱性,紫色石蕊溶液滴入NaOH溶液中,溶液会变成蓝色。
(2)从图2的微观示意图来分析,该反应是硫酸和氢氧化钠反应生成硫酸钠和水,,反应的化学方程式为![]() ;从该图还可以看出,反应后的溶液没有氢离子,也没有氢氧根离子,所以溶液的pH=7。
;从该图还可以看出,反应后的溶液没有氢离子,也没有氢氧根离子,所以溶液的pH=7。
(3)A、HCl是酸,虽然能与氢氧化钠反应,但不是氢氧化钠与盐的反应,不符合题意;
B、Na2CO3是盐,但与氢氧化钠不反应,不符合题意;
C、CuSO4是盐,与氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,符合题意。故选C。
(4)根据在化学反应中元素种类和原子个数不变的原则。可用奇偶配数法进行配平,首先观察反应中生成物氢气中原子个数为2,为偶数,则反应物氢氧化钠中氢原子个数为1,单数,前面需配2,同样水中氧原子个数是1,为单数,前面需配2,则铝和偏铝酸钠前都配2,最后,反应前氢原子能总数为6个,所以生成物氢气前需配3,得到该反应的化学方程式为:2NaOH + 2H2O + 2Al= 2NaAlO2 + 3H2↑。

【题目】实验室有一瓶标签受损的无色溶液(标签如图所示)。同学们决定对其成分进行探究。他们首先向老师请教,老师告诉他们初中化学实验室中的含钠化合物可能是NaOH、NaCl、Na2SO4、NaNO3、Na2CO3、NaHCO,并给出相关资料,让同学们结合所学知识进行探究。
![]()
(相关资料)(1)NaOH、Na2CO3、NaHCO3的溶液呈碱性,NaCl、Na2SO4、NaNO3的溶液呈中性。
(2)NaHCO3属于可溶物质(室温下溶解度小于10g),而其它物质属于易溶物质(室温下溶解度大于10g)。
(交流讨论)同学们一致认为该溶液一定不是NaHCO3溶液,他们的理由是____。
(实验探究)为确定该溶液的成分,同学们进行了如下实验。
步骤 | 实验操作 | 实验现象 | 实验结论 |
Ⅰ | 用玻璃棒蘸取溶液滴到pH试纸上,把试纸显示的颜色与____进行比较 | 试纸条变蓝 | 该溶液的pH=10,通过比较。可能是____。 |
Ⅱ | 取少量溶液于试管中向其中滴加足量的稀盐酸。 | ____ | 该溶液为Na2CO3溶液。有关反应的化学方程式为____。 |
(反思评价)老师指出该结论不严密。理由是若该溶液为NaOH溶液,在空气中发生变质,也能产生上述现象。请写出NaOH在空气中变质反应的化学方程式:____。
【题目】一些食物的近似pH如下表:
食物 | 苹果 | 葡萄 | 牛奶 | 玉米 |
pH | 2.9~3.3 | 3.5~4.5 | 6.3~6.6 | 6.8~8.0 |
(1)苹果汁和葡萄汁相比较,酸性较强的是________,它能使石蕊试液变________色。
(2)人的胃液中含有盐酸,对于胃酸过多的人,空腹时最宜食用的食物是________。
(3)鸡蛋壳中含有CaCO3,以前因胃酸过多导致胃痛时,有人吃鸡蛋壳粉。现今,许多冶疗胃酸过多的药品的有效成分是氢氧化铝,而不是CaCO3,提出一种理由说明为什么氢氧化铝优越于碳酸钙________,写出氢氧化铝与胃酸反应的化学方程式________。