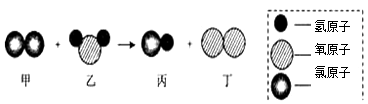
��Ŀ����
����Ŀ����ʽ̼��ͭ��һ����;�㷺�Ļ���ԭ�ϣ���ҵ�Ͽ��õ��ӹ�ҵ�п�ʴ��·������Է�Һ����Ҫ�ɷ���FeCl3��CuCl2��FeCl2���Ʊ���
����ҵ�Ʊ���
�����ϲ�ѯ��1����ӦA�������Ƶ������ǽ�FeCl2������FeCl3 �� 2��Cu2+��Fe3+���ɳ���ʱ��pH���£�
�� �� | Cu��OH��2 | Fe ��OH��3 |
��ʼ����pH | 4.2 | 1.2 |
��ȫ����pH | 6.7 | 3.2 |
��1����������Ҫ�ɷ�����д��ѧʽ����
��2�����ڷ�ӦA����Һ��pH��ΧӦΪ ��
��3����ӦB���¶�����ߣ�����������ɫ��Ʒ�п��ܻ���ֵĺ�ɫ��������д��ѧʽ����
��4�����˵õ��IJ�Ʒ��������ˮϴ�ӣ�Ϊ�����Ƿ�ϴ�Ӹɾ�����ȡ���һ��ϴ��Һ���ȼ��� �� �ٵμ� �� �۲쵽 �������ϴ����
��5������ɲⶨ����ʽ̼��ͭ����ɿɱ�ʾΪ��aCuCO3bCu��OH��2cH2O��ij�о�С���������ʵ��װ�ã�
�����ϲ�ѯ����CuCO3��Cu��OH��2�����ֽ⣬�����ɶ�Ӧ�����������
��ַ�Ӧ���ã���A����Ʒ����Ϊ12.0g����A��ʣ���������Ϊ8.0g����Bװ������1.8g����Cװ������2.2g������װ�þ�������գ�������װ���п�����Ӱ�죩
B�е��Լ��� �� C�е��Լ��� �� D�е��Լ���������ĸ��ţ���
a����ʯ�� b��Ũ���� c����ˮ����ͭ d��ŨNaOH��Һ
��6��Ҫ����ó���Ʒ����ɣ�ֻ��ʵ�����ĸ������е��������ɣ�����е����Ϊ������ţ���ѡ��ѡ�����֣���
a���ڢۢ�b���٢ۢ�c���٢ڢ�d���٢ڢ�
ͨ������ɵü�ʽ̼��ͭ��aCuCO3bCu��OH��2cH2O����a��b��c= ��
��7��D������ �� ����Dװ��ȥ����aֵ�����ƫ����ƫС�����䡱��
���𰸡�
��1��Fe��OH��3
��2��3.2��4.2
��3��3.2��4.2
��4��AgNO3��HNO3������������
��5��c��d��a
��6��abcd��1��1��1
��7����ֹ�����е� CO2����C�У�ƫ��
���������⣺��1���������Ӳ����׳�ȥ�����������ƽ���������ת���������ӣ�Ȼ��ͨ������pHֵ��������ת����������������������ȥ��������������Ҫ�ɷ���Fe��OH��3����2�����ڵ�pHֵʹͭ���Ӳ��ܳ����������ӿ�ʼ���ֳ�����ͨ���������е����ݿ��Կ�����ͭ������pHֵ��4.2ʱ����ʼ��������������pHֵ��3.2ʱ����ʼ���������Ե��ڷ�ӦA����Һ��pH��ΧӦΪ��3.2��4.2����3����Ӧ�¶ȹ��ߣ�̼��ͭ��������ͭ����ֽ���������ͭ�����Է�ӦB���¶�����ߣ�����������ɫ��Ʒ�п��ܻ���ֵĺ�ɫ������CuO����4��������������Ҫ�������ữ�����������飬���Թ��˵õ��IJ�Ʒ��������ˮϴ�ӣ�Ϊ�����Ƿ�ϴ�Ӹɾ�����ȡ���һ��ϴ��Һ���ȼ������������ټ���ϡ���ᣬ�۲쵽û�����������������ϴ������5����ˮ����ͭ��ˮ����ɫ���������ƻ��������̼��Ӧ����ʯ�һ��������̼��ˮ��Ӧ������B�е��Լ�����ˮ����ͭ��C�е��Լ�������������Һ��D�е��Լ��Ǽ�ʯ�ң���6����Ʒ���������������aCuCO3bCu��OH��2cH2O�а��������֣�֪�����������ֵ����ݣ���һ���ֵ����ݿ���ͨ����Ʒ��������֪�����ֵ�������ã����Կ��е����Ϊ��abcd��
��ַ�Ӧ���ã���A����Ʒ����Ϊ12.0g����A��ʣ���������Ϊ8.0g����Bװ������1.8g����Cװ������2.2g����������ͭ����Ϊ8g������ˮ������Ϊ1.8g��������̼������Ϊ2.2g��
aCuCO3bCu��OH��2cH2O | ��a+b��CuO+ | ��b+c��H2O+ | aCO2�� |
80��a+b�� | 18��b+c�� | 44a | |
8g | 1.8g | 2.2g |
![]() =
= ![]() =
= ![]()
a��b��c=1��1��1
��7�������еĶ�����̼�����������Ʒ�Ӧ��ʹ�������Ƶ���������ƫ�Ӷ�ʹ�����̼��ͭ��������

 �żӾ���ϵ�д�
�żӾ���ϵ�д�