题目内容
【题目】下列变化中,前者是物理变化,后者是化学变化的是( )
A.汽油燃烧 铁生锈
B.汽油挥发 工业上制取氧气
C.冰雪融化 食物腐烂
D.水的电解 水的沸腾
【答案】C
【解析】A、汽油燃烧、铁生锈过程中都有新物质生成,都属于化学变化.
B、汽油挥发、工业上制取氧气过程中都没有新物质生成,都属于物理变化.
C、冰雪融化过程中只是状态发生改变,没有新物质生成,属于物理变化;食物腐烂过程中有新物质生成,属于化学变化.
D、水的电解过程中有新物质生成,属于化学变化;水的沸腾过程中只是状态发生改变,没有新物质生成,属于物理变化.
故选C.

【题目】某运动型饮料的成分含量如图所示,其中钾、钙、钠指的是( )
某运动型饮料 |
A.单质
B.原子
C.元素
D.分子
【题目】碱式碳酸铜是一种用途广泛的化工原料.工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,
【工业制备】
【资料查询】1.反应A中氯酸钠的作用是将FeCl2氧化成FeCl3 . 2.Cu2+、Fe3+生成沉淀时的pH如下:
物 质 | Cu(OH)2 | Fe (OH)3 |
开始沉淀pH | 4.2 | 1.2 |
完全沉淀pH | 6.7 | 3.2 |
(1)滤渣的主要成分是(写化学式).
(2)调节反应A后溶液的pH范围应为 .
(3)反应B的温度如过高,则所得蓝绿色产品中可能会出现的黑色固体是(写化学式).
(4)过滤得到的产品可用蒸馏水洗涤,为检验是否洗涤干净,可取最后一次洗涤液,先加入 , 再滴加 , 观察到 则表明已洗净.
(5)【组成测定】碱式碳酸铜的组成可表示为:aCuCO3bCu(OH)2cH2O.某研究小组设计如下实验装置.
【资料查询】:CuCO3、Cu(OH)2受热易分解,各生成对应的两种氧化物.
充分反应后测得:①A中样品质量为12.0g,②A中剩余固体质量为8.0g,③B装置增重1.8g,④C装置增重2.2g.(各装置均充分吸收,不考虑装置中空气的影响)
B中的试剂是 , C中的试剂是 , D中的试剂是(填字母序号);
a.碱石灰 b.浓硫酸 c.无水硫酸铜 d.浓NaOH溶液
(6)要计算得出样品的组成,只需实验测得四个数据中的三个即可,则可行的组合为(填序号,多选少选不给分).
a.②③④b.①③④c.①②④d.①②③
通过计算可得碱式碳酸铜(aCuCO3bCu(OH)2cH2O)中a:b:c= .
(7)D的作用 . 若将D装置去掉,a值将(填“偏大”、“偏小”或“不变”)
【题目】氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂,某研究性学习小组模拟生产企业制取氢化钙. 【查阅资料】
Ⅰ白色的无水硫酸铜粉末吸水后会变蓝;
Ⅱ碱石灰是氧化钙和氢氧化钠的混合物;
Ⅲ钙、氢化钙遇水立即发生剧烈反应:Ca+2H2O=Ca(OH)2+H2↑;CaH2+2H2O=Ca(OH)2+2H2↑;
Ⅳ钙能燃烧生成氧化钙;氢化钙能燃烧生成氧化钙和水.
【实验原理】
用锌粒和稀硫酸反应制得干燥、纯净的氢气,再与金属钙在加热的条件下直接化合,即可制得CaH2 .
(1)同学们设计了以下实验装置: 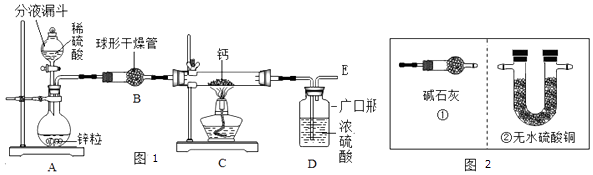
请回答:
①装置A中发生反应的化学方程式为;为了实验安全,点燃C装置酒精灯前应先;
②上图1装置B中装有无水氯化钙,其作用是干燥H2 , 若要证明进入C装置中的氢气已经干燥,在B、C之间应连接图2中的(选填:①或②)装置;
③图1装置D中浓硫酸的作用是;
(2)【进行实验)过程略 【验证产物】略
【实验拓展】定性实验用化学方法鉴别Ca与CaH2 , 完成下表中内容.
实验步骤 | 预期现象和结论 |
取少量固体样品,在干燥条件下与氧气反应,将 |
(3)定量实验:测定Ca和CaH2混合物中CaH2的质量分数. 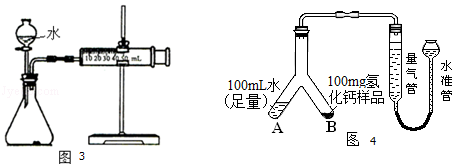
①取m1g样品与水完全反应,利用如图3装置测定生成的气体体积时,在时进行收集(选填字母);
a.刚开始有气泡时 b.气泡连续均匀冒出时 C.气体经过验纯
②按图3实验装置进行测定时,甲同学发现,即使气密性良好,操作正确,测得的气体体积还是偏大,可能原因是;(写出任一点即可)
③乙同学将实验装置改进为如图4(固定装置省略)所示,调整水准管高度,使量气装置两边的液面保持在同一水平面上,读取量气管中液面所示刻度为10.0mL.将Y形管慢慢倾斜,直至A中的水全部倒入B中,与样品混合反应,待反应结束后,冷却至室温,再次调节量气管与水准管液面相平,读取量气管中液面所示刻度为98.9mL.已知该实验条件下,氢气的密度为0.09mg/mL.样品中氢化钙的质量分数为;(结果精确到0.1%)
(4)【反思与交流】 登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是氢化钙是固体,携带方便.既然金属钙与水反应也能生成氢气,为什么还要将金属钙制备成氢化钙呢?你的观点是 .
