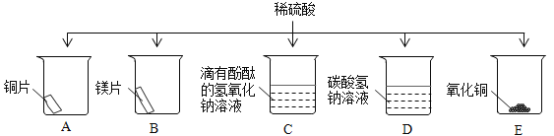
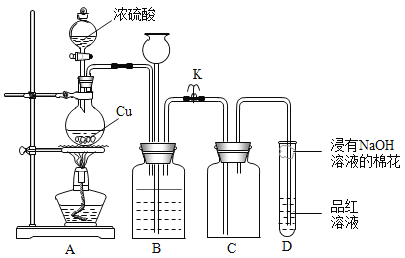
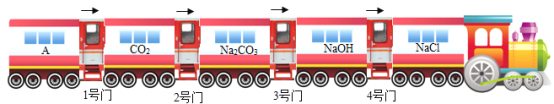
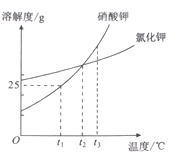
题目内容
【题目】农业上常用溶质质量分数为16%的NaCl溶液选种。实验室配制100g该溶液的过程如下图所示。下列说法不正确的是
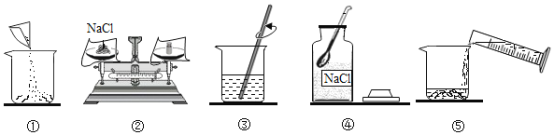
A.实验操作顺序为④②①⑤③
B.②中需称量NaCl的质量为16.0g
C.选用100mL量筒量取所需水的体积
D.用量筒量取水时仰视读数所得溶液的溶质质量分数偏大
【答案】D
【解析】
A、配制100g16%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解,实验操作顺序为④②①⑤③,故选项说法正确。
B、溶质质量=溶液质量×溶质的质量分数,配制16%的氯化钠溶液100g,需氯化钠的质量=100g×16%=16g,故选项说法正确。
C、溶剂质量=溶液质量-溶质质量,所需溶剂的质量为100g-16g=84g(合84mL),应用规格为100mL的量筒量取水的体积,故选项说法正确。
D、用量筒量取水时仰视读数,造成所量取的水体积偏大,所得溶液的溶质质量分数偏小,故选项说法错误。
故选:D。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】中和反应是化学核心概念之一。某化学兴趣小组对中和反应展开了探究。
(实验目的)证明氢氧化钠溶液与盐酸发生化学反应。
(实验步骤)
步骤一:取一定量稀氢氧化钠溶液于烧杯中,滴加2滴酚酞试液,溶液呈红色。
步骤二:用仪器A吸取稀盐酸向烧杯中逐滴加入,边滴加边用玻璃棒搅拌,红色变浅直至消失。
步骤三:向溶液中继续滴加稀盐酸至溶液呈酸性,用玻璃棒蘸取其中溶液,在酒精灯上加热至蒸干,有白色固体产生。
(思考拓展)
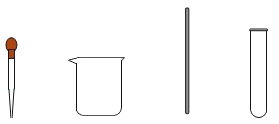
(1)从下列仪器中选择步骤二中的“仪器A”,名称是_________。
(2)兴趣小组认为仅从上述步骤二的现象,难以证明盐酸与氢氧化钠发生了反应。
查阅资料:(i)酚酞试液在不同的pH时变化情况如下:
pH | 0~8.2 | 8.2~10.0 | 10.0~14.0 |
颜色 | 无色 | 粉红色 | 红色 |
(ⅱ)氢氧化钠溶液的pH随浓度的降低而减小。
兴趣小组据此形成了对比实验方案以排除干扰,该对比实验方案是_____。
(3)为确认步骤三中的白色固体是氯化钠而不是氢氧化钠,进行如下实验:
步骤 | 现象 | 结论 | |
将白色固体溶于水形成溶液,均分成两等份 | 向其中一份滴加CuSO4溶液,振荡、静置 | ①无___色沉淀生成 | 白色固体不是NaOH。 |
向另一份滴加AgNO3溶液,振荡、静置 | 出现白色沉淀 | ②白色固体是NaCl,反应的化学方程式为___。 | |
(继续探究)
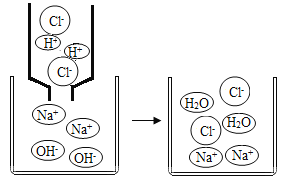
(4)如图是氢氧化钠与盐酸反应的微观示意图。从微观角度分析,氢氧化钠溶液和盐酸反应的实质是__________。
(5)兴趣小组认为上述实验对反应实质缺少直观的验证。
査阅资料:(ⅲ)变色硅胶为蓝色,吸水后呈红色。(ⅳ)变色硅胶与NaOH固体充分混合,无明显现象;变色硅胶与无水醋酸(CH3COOH)充分混合,无明显现象。
兴趣小组据此设计了如图实验,验证中和反应有水生成:将无水醋酸迅速倒入装有NaOH固体和变色硅胶的试管中,并用玻璃棒在试管中不断搅拌,观察到变色硅胶由蓝色逐渐变为红色,U型管内液面左低右高。

①U型管内液面左低右高说明该反应____热量(填写“放出”或“吸收”)。
②无水醋酸由CH3COO-和H+构成。变色硅胶由蓝色变成红色的原因是______(用化学方程式表示)。
【题目】某同学在帮助实验员整理化学试剂时发现了一瓶标签残缺的无色溶液(如图甲所示),经实验员分析可知原瓶溶液中的溶质可能是NaCl、NaOH、Na2CO3、NaHCO3中的一种,为确认溶液中的溶质,他设计并进行了如下探究活动。
(资料查阅)上述四种物质的相关信息如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下稀溶液的pH | 7 | 13 | 11 | 9 |
请回答下列问题:
(实验探究1)
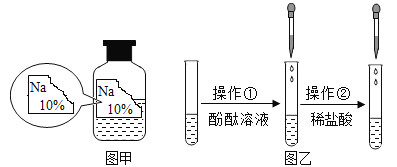
如上图乙所示,在操作①后可确定溶质不是NaCl,则实验现象应是______;在进行操作②时有无色无味气体产生,由此又可排除的物质是__________。
(探究结论)分析四种物质的相关信息,你认为该溶液中的溶质可能是上述四种物质中的______,你的判断依据是__________。若上述探究结论是正确的,操作②发生反应的化学方程式为_____________。
(讨论质疑)有同学认为以上分析不严密,需要进一步实验确定,于是又进行了如下探究。
(实验探究2)向操作①后试管中的溶液中滴加过量CaC12溶液(中性),充分反应后,试管中溶液颜色不变,又有白色沉淀产生。
(得出结论)通过实验探究2可确定原瓶溶液中的溶质应该是_________。
(反思拓展)造成该溶液出现上述实验现象的原因是______________(用化学方程式表示)。