题目内容
【题目】某纯碱样品中含有少量氯化钠。为测定样品中碳酸钠的质量分数,现称取该样品11g,加入到盛有50g稀盐酸的烧杯中,恰好完全反应,最后称得烧杯中溶液的质量为56.6g。计算:
(1)完全反应后生成CO2的质量_______;
(2)纯碱样品中碳酸钠的质量分数_________(结果精确到0.1%)
【答案】4.4g 96.4%
【解析】
(1)根据质量守恒定律,完全反应后生成二氧化碳的质量=11g+50g-56.6g=4.4g
(2)设参加反应的碳酸钠的质量为x
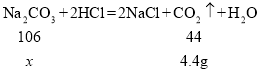
![]() =
=![]()
x=10.6g
纯碱样品中碳酸钠的质量分数=![]() ×100%≈96.4%
×100%≈96.4%
答:(1)完全反应后生成CO2的质量为4.4g;(2)纯碱样品中碳酸钠的质量分数约为96.4%.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】我国约在南北朝时就开始冶炼黄铜,黄铜是铜和锌的合金(Cu-Zn),它可以用来制造电器零件及日用品。小华利用一瓶稀盐酸和相关的仪器,测定黄铜样品的组成(不考虑铜中的其它杂质)。将30ml稀盐酸分别加入到10g黄铜粉末中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
第一次 | 第二次 | 第三次 | |
连续加入盐酸的体积/mL | 10 | 10 | 10 |
生成氢气的质量/g | 0.08 | 0.08 | 0.04 |
(1)从上表数据分析,小华用10g合金粉末共收集到氢气 g;
(2)求该合金中铜的质量分数。
【题目】有一包白色粉末可能含有氯化钡、碳酸钡、碳酸钠、氢氧化钠和硫酸钠中的一种或几种,取一定量该粉末样品加入到盛有足量水的烧杯中,搅拌,静置,观察到烧杯中有白 色不溶物。同学们将烧杯中的物质过滤,得到滤渣A和滤液B,取滤渣A于试管中滴加过 量稀盐酸,观察到滤渣全部溶解,并有气泡产生。为确定白色粉末的组成,同学们进一步设计了如下实验方案:

(查阅资料)硝酸钠、硝酸钡、氯化钡溶液均显中性。
针对上述实验方案中各步骤的现象,小明同学提出下列三种不同的假设,依据每种假 设中各步骤不同的实验现象,可得出不同的实验结论。
步骤一 | 步骤二 | 步骤三 | |
假设一 | 有白色沉淀生成 |
|
|
假设二 | 无白色沉淀生成 | 溶液变红 | 溶液变成无色 |
假设三 | 无白色沉淀生成 | 无明显现象 | 无明显现象 |
(1)依据假设一的现象,可确定原白色粉末中只含有碳酸钡、碳酸钠、氢氧化钠和硫酸钠四种物质,则步骤二的现象是____;步骤三的现象是____;步骤一中发生反应的化学方程式是____(写出一个即可)。
(2)依据假设二的现象,原白色粉末可能的组成是___(任写一种可能的组 成,用化学式表示),步骤三中发生反应的化学方程式是____。
(3)依据假设三的现象,原白色粉末可能的组成有_____种。