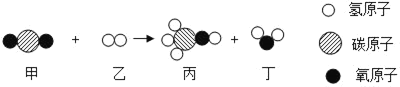
题目内容
【题目】某化学兴趣小组在完成“常见金属的性质”实验时进行了以下一些探究活动。
[探究话动]:将铝丝插入硫酸铜溶液中未发现明显的实验现象。
[现象分析]:(1)请分析出现上述实验现象的原因:____。为顺利完成实验,你的建议是___
[继续实验]:(2)兴趣小组同学根据你的建议,重新进行了实验,观察到了明显的实验现象。经充分反应后,该实验的现象是____.
(3)经研究发现该反应的微观示意图如下图所示(图中微粒未完全画出)。则用实际参加反应的微粒符号来表示化学反应的式子是_____
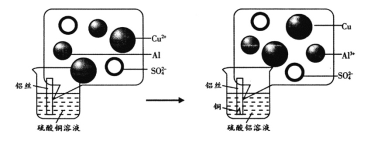
(4)兴趣小组在完成上述实验时,还发现了铝丝表面有少量气泡生成。根据已有知识和资料信息判断这种气体有可能是_____(资料信息:硫酸铜在水中会发生一些变化,生成微量的稀硫酸),反应的化学方程式是___
【答案】铝丝表面有一层致密的氧化膜 用砂纸打磨铝丝 铝丝表面有红色的物质生成,溶液变成无色 3Cu2++2Al=3Cu+2Al2+ H2 2Al+3H2SO4=Al(SO4)2+3H2↑
【解析】
(1)铝表面氧化物保护膜阻碍了反应的发生,应先用砂纸除去铝表面的保护膜,故答案为:铝表面氧化物保护膜阻碍了反应的发生;用砂纸除去铝表面的保护膜;
(2)铝和硫酸铜反应生成铜和硫酸铝,现象为:铝表面有红色物质生成,溶液由蓝色变成无色,故答案为:铝表面有红色物质生成,溶液由蓝色变成无色;
(3)实际参加反应的是Al和Cu2+,化学反应可表示为:2Al+3Cu2+=2Al3++3Cu,故答案为:2Al+3Cu2+=2Al3++3Cu;
(4)根据已有知识和资料信息可知,铝丝表面生成的少量气泡可能是氢气,反应的化学方程式为:2Al+3H2SO4=Al2(SO4)4+3H2↑,
故答案为:氢气 2Al+3H2SO4=Al2(SO4)4+3H2↑。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】如表是NaCl和KNO3在不同温度时的溶解度,其变化趋势如图所示,下列推理合理的是( )
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
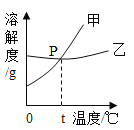
A. 100g水里最多能溶解KNO331.6g
B. 表示NaCl的溶解度曲线是甲
C. 温度t的范围可能在20℃﹣30℃之间
D. 不饱和溶液变为饱和溶液,溶质的质量分数增大
【题目】如图是实验室制取气体的常用装置,请根据图回答下列问题。
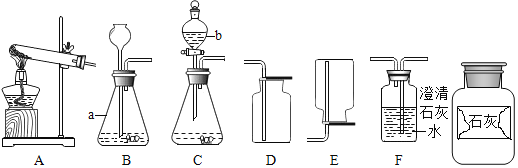
(1)写出图中标有序号的仪器名称:a______;b______。
(2)若使用装置A制取氧气,应______(填改进措施)方可继续实验,其化学方程式是______。
(3)某广口瓶上的标签已破损,只剩下“石灰”两个字,已知该样品未变质。某兴趣小组设计实验探究该药品的成分,请完成以下实验报告。
实验步骤 | 实验现象 | 结论 |
取少量瓶中的固体于烧杯中,加入适量水,并感知烧杯壁的温度 | ______ | 固体不是生石灰 |
取上述烧杯中的少量上层清液于试管中,滴加酚酞试液 | 无明显现象 | 固体不是熟石灰 |
取少量瓶中的固体于装置B中,加入适量稀盐酸 | 产生大量气泡,装置F中的澄清石灰水变浑浊 | F中涉及化学方程式为 ______ |
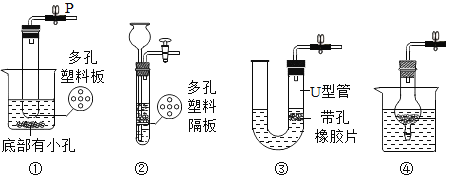
(4)确定药品的成分后,兴趣小组选用了图中的______(填序号),可实现控制反应的发生与停止。