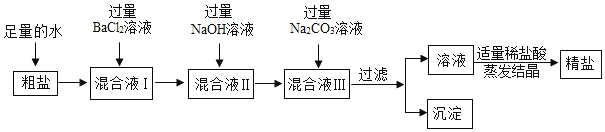
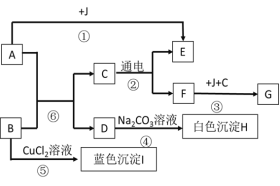
题目内容
【题目】已知溶液的导电性与单位体积内离子的数目、离子所带电荷多少有关,单位体积内离子数目越多,导电性越强;离子所带电荷越多,导电性越强(如两个氯离子和一个硫酸根离子导电性相当)。现向含有Ca(OH)2和NaOH的混合液中通入CO2气体,下列测得溶液导电性(用“电流强度I”表示)变化与通入CO2气体体积(V)关系图象正确的是( )
A.  B.
B. 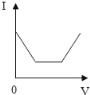
C. 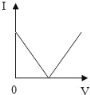 D.
D. 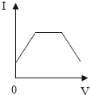
【答案】B
【解析】
一开始二氧化碳与氢氧化钙反应生成碳酸钙沉淀,此时溶液离子减少,导电性减弱,当二氧化碳和氢氧化钙反应完毕后,此时导电性减少到最弱,继续通二氧化碳,又会与氢氧化钠反应生成了碳酸钠,溶液的导电能力不变,当碳酸钠反应成后,二氧化碳碳酸钙和碳酸钠生成可溶性的碳酸氢钙和碳酸氢钠,溶液中离子增多导电性增强;分析所给的选项可以知道选项B符合我们刚才的分析,即B是正确的。
故选:B。

练习册系列答案
相关题目