题目内容
【题目】完成下列基本实验问题:
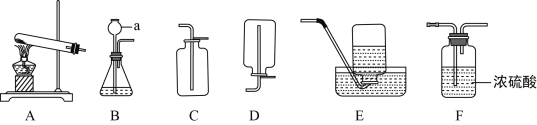
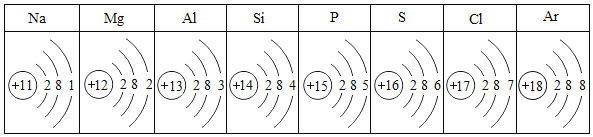
(1)写出图中编号a仪器的名称:_____。
(2)用氯酸钾和二氧化锰制氧气的化学方程式为_____,若要获得较纯净的氧气,应选用的收集装置是_____(填字母序号)。
(3)若用锌粒和稀硫酸制取和收集干燥的H2,应选择的装置组合为_____(填字号),制取氢气的化学方程式为_____。
(4)实验室制取二氧化碳的化学方程式_____。检验二氧化碳已集满的操作是_____。
【答案】长颈漏斗 2KClO3![]() 2KCl+3O2
2KCl+3O2![]() E BFD
E BFD ![]()
![]() 将燃着的小木条放在集气瓶口,若木条熄灭则证明二氧化碳已经收集满
将燃着的小木条放在集气瓶口,若木条熄灭则证明二氧化碳已经收集满
【解析】
(1)长颈漏斗方便加液体药品,故答案为:长颈漏斗;
(2)如果用氯酸钾制氧气就需要加热,氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,化学方程式为: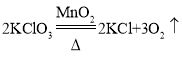 ,氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集,用E装置即排水法收集的氧气比较纯净;
,氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集,用E装置即排水法收集的氧气比较纯净;
(3)实验室是用锌粒和稀硫酸在常温下反应制氢气的,锌粒和稀硫酸反应生成硫酸锌和氢气,反应方程式为:![]() ,氢气难溶于水,密度比空气的密度小,因此可以用排水法和向下排空气法收集,用向下排空气法收集的氢气比较干燥;氢气可以用浓硫酸干燥;故选装置组合为:BFD;
,氢气难溶于水,密度比空气的密度小,因此可以用排水法和向下排空气法收集,用向下排空气法收集的氢气比较干燥;氢气可以用浓硫酸干燥;故选装置组合为:BFD;
(4)实验室制取二氧化碳,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,反应方程式为:![]() ,二氧化碳的验满方法是:将燃着的小木条放在集气瓶口,若木条熄灭则证明二氧化碳已经收集满。
,二氧化碳的验满方法是:将燃着的小木条放在集气瓶口,若木条熄灭则证明二氧化碳已经收集满。

【题目】黄铜是铜和锌的合金。某化学兴趣小组的同学欲测定实验室中某黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。称量10g粉末状黄铜样品放入烧杯中,量取45mL稀硫酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
第一次 | 第二次 | 第三次 | |
加入稀硫酸的体积(mL) | 15 | 15 | 15 |
生成氢气的质量(g) | m | 0.04 | 0.02 |
试求:
(1)m的数值_____。
(2)此黄铜样品中铜的质量分数是少?_____(写出计算过程)