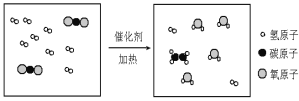
题目内容
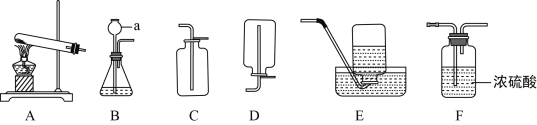
【题目】根据下列11~18号元素的原子结构示意图,回答有关问题;
(1)硅原子质子数为_______;
(2)Mg与上述某元素形成的物质中,原子个数比为1:2,该物质的化学式为_______;
(3)Si、P、S、C1四种元素属于非金属元素,从原子结构上分析,依据是_______。
【答案】14 MgCl2 最外层电子数等于或多于4个
【解析】
(1)由硅的原子结构示意图不难看出,它的质子数是14;
(2)由于镁原子的最外层上有2个电子,易失去这两个电子,故镁元素在化合物中一般为+2价,它与某元素形成的物质中原子个数比为1:2,说明另外一种元素应为﹣1价,即它的原子在化学变化中易得一个电子,因此该原子应为氯原子,该物质的化学式为:MgCl2;
(3)由Si、P、S、Cl四种元素的原子结构示意图可以看出:最外层电子数等于或多于4个,由此可以推出非金属元素的最外层电子数多于4个。

 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案【题目】能源、水和溶液与人们的生活息息相关。
(1)目前人们利用最多的化石燃料是煤、_____和石油。
(2)车用乙醇汽油可适当节省石油资源,并在一定程度上减少汽车尾气的污染,乙醇燃烧的化学方程式为_____。
(3)检验水是硬水还是软水,可用的物质是_____,日常生活中使硬水软化的方法是_____。
(4)表是三种物质在不同温度时的溶解度,根据表中信息回答问题。
温度/℃ | 20 | 40 | 50 | 60 | 80 | |
溶解度/g | KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 |
K2CO3 | 110 | 114 | 121 | 126 | 139 | |
Ca(OH)2 | 0.17 | 0.16 | 0.14 | 0.12 | 0.09 | |
①80℃时,KNO3的溶解度_____K2CO3的溶解度(填“>”、“=”或“<”)。
②50℃时,200g饱和K2CO3溶液蒸发10g水后,再降温到50℃,可析出K2CO3晶体的质量是_____g。
③将100g 60℃的Ca(OH)2饱和溶液降温至20℃,溶液中溶质的质量_____(填“变大”、“不变”或“变小”)。
④40℃时,向两个分别盛有相同质量的KNO3和K2CO3的烧杯中,各加入100g水,充分溶解后,恢复至40℃,其结果如图所示。下列有关说法中,正确的有_____(填序号)。
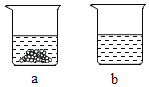
A 烧杯a中溶质是KNO3,烧杯b中溶质是K2CO3
B 烧杯b中溶液一定是不饱和溶液
C 降低温度或蒸发都有可能使烧杯b中析出固体
D 若将烧杯a中的溶液变为不饱和溶液,溶液中溶质质量分数定会减小