题目内容
乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属.乙炔由碳化钙(块状固体,化学式为CaC2)与水反应生成,同时生成一种白色固体.
【提出问题】白色固体是什么物质?
【做出猜想】小明经过思考认为有以下几种可能:
猜想一:CaO;猜想二:______;猜想三:Ca(OH)2.
他的依据是______.
【交流反思】经过同学们交流讨论,认为猜想一不成立.否定猜想一的理由是:______.
【进行实验】(一)取少量白色固体放入试管中,滴加稀盐酸,没有观察到______
______,证明猜想二不成立.
(二)取少量白色固体加入到水中,取上层清液,______,有白色沉淀出现,证明猜想三成立.该反应的化学方程式为:______.
结论:白色固体是Ca(OH)2.
【拓展应用】
(1)已知碳化钙与水反应非常剧烈,乙炔的密度比空气略小.实验室欲制取并收集纯净的乙炔,要求做到节约、安全、随时发生、随时停止,你选择的装置是______(选填图中装置序号).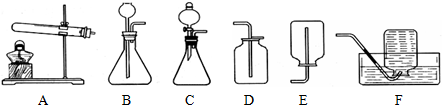
(2)写出乙炔在空气中燃烧的化学方程式______.
【提出问题】白色固体是什么物质?
【做出猜想】小明经过思考认为有以下几种可能:
猜想一:CaO;猜想二:______;猜想三:Ca(OH)2.
他的依据是______.
【交流反思】经过同学们交流讨论,认为猜想一不成立.否定猜想一的理由是:______.
【进行实验】(一)取少量白色固体放入试管中,滴加稀盐酸,没有观察到______
______,证明猜想二不成立.
(二)取少量白色固体加入到水中,取上层清液,______,有白色沉淀出现,证明猜想三成立.该反应的化学方程式为:______.
结论:白色固体是Ca(OH)2.
【拓展应用】
(1)已知碳化钙与水反应非常剧烈,乙炔的密度比空气略小.实验室欲制取并收集纯净的乙炔,要求做到节约、安全、随时发生、随时停止,你选择的装置是______(选填图中装置序号).

(2)写出乙炔在空气中燃烧的化学方程式______.
【做出猜想】
猜想一:CaO;猜想二CaCO3;猜想三:Ca(OH)2;
他的依据是质量守恒定律;
【交流反思】
经过同学们交流讨论,认为猜想一不成立.否定猜想一的理由是:CaO能与水反应;
【进行实验】
(一)取少量白色固体放入试管中,滴加稀盐酸,没有观察到气泡放出,证明猜想二不成立;
(二)取少量白色固体加入到水中,取上层清液,通入二氧化碳气体,有白色沉淀出现,证明猜想三成立.该反应的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O;
【拓展应用】
装置C中的分液漏斗能使反应随时发生、随时停止,乙炔的密度比空气略小,不能用排空气法收集,只能够用排水法收集;
故填:C、F;
乙炔在空气点燃生成二氧化碳和水,反应的方程式为:2C2H2+5O2
4CO2+2H2O.
故答案为:【做出猜想】CaCO3质量守恒定律
【交流反思】
氧化钙与水发生反应生成氢氧化钙;
【进行实验】(一)产生气泡;
(二)通入二氧化碳气体;
Ca(OH)2+CO2=CaCO3↓+H2O;
【拓展应用】
(1)C、F;
(2)2C2H2+5O2
4CO2+2H2O.
猜想一:CaO;猜想二CaCO3;猜想三:Ca(OH)2;
他的依据是质量守恒定律;
【交流反思】
经过同学们交流讨论,认为猜想一不成立.否定猜想一的理由是:CaO能与水反应;
【进行实验】
(一)取少量白色固体放入试管中,滴加稀盐酸,没有观察到气泡放出,证明猜想二不成立;
(二)取少量白色固体加入到水中,取上层清液,通入二氧化碳气体,有白色沉淀出现,证明猜想三成立.该反应的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O;
【拓展应用】
装置C中的分液漏斗能使反应随时发生、随时停止,乙炔的密度比空气略小,不能用排空气法收集,只能够用排水法收集;
故填:C、F;
乙炔在空气点燃生成二氧化碳和水,反应的方程式为:2C2H2+5O2
| ||
故答案为:【做出猜想】CaCO3质量守恒定律
【交流反思】
氧化钙与水发生反应生成氢氧化钙;
【进行实验】(一)产生气泡;
(二)通入二氧化碳气体;
Ca(OH)2+CO2=CaCO3↓+H2O;
【拓展应用】
(1)C、F;
(2)2C2H2+5O2
| ||

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目