题目内容
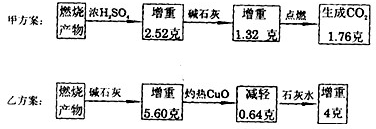
烃是由碳和氢两种元素组成的有机化合物.为了测定气态烃A的化学式,取一定量的A置于密闭容器中燃烧,定性实验表明产物是CO2、CO和水蒸气.甲、乙两学生设计了如下两个实验方案,均认为根据自己的方案能求出A的最简式(烃中碳与氢原子个数的最简比).他们测得的有关数据如图中所示(图中的箭头表示气体的流向,实验前系统内的空气已排除):
试回答:
(1)根据两方案,你认为谁能求出A的最简式______(填“甲”或“乙”).
(2)请根据你选出的方案,通过计算求出A的最简式.即C:H=______.
(3)若要确定A的化学式,是否还需要测定其它数据______.原因是______.
(4)烃A在密闭容器中燃烧生成CO2、CO和水蒸气的反应化学方程式为______.
(5)烃A在光照条件下,可与Cl2反应,除生成HCl气体外,还可依次生成CH3Cl、CH2Cl2、CHCl3、CCl4,分别写出烃A与Cl2在光照条件下发生的四个化学反应方程式:______.

试回答:
(1)根据两方案,你认为谁能求出A的最简式______(填“甲”或“乙”).
(2)请根据你选出的方案,通过计算求出A的最简式.即C:H=______.
(3)若要确定A的化学式,是否还需要测定其它数据______.原因是______.
(4)烃A在密闭容器中燃烧生成CO2、CO和水蒸气的反应化学方程式为______.
(5)烃A在光照条件下,可与Cl2反应,除生成HCl气体外,还可依次生成CH3Cl、CH2Cl2、CHCl3、CCl4,分别写出烃A与Cl2在光照条件下发生的四个化学反应方程式:______.
(1)根据甲方案:燃烧产物
| 浓硫酸 |
| 碱石灰 |
| 点燃 |
(2)根据方案甲,可以知道H2O-m(H)-n(H) CO2--m(C)--n(C)
2.52g 0.28g0.28mol1.30g+1.76g0.8345g
| 0.8345g |
| 12g/mol |
所以n(C):n(H)=
| 0.8345g |
| 12g/mol |
(3)CH4中H的百分含量已经达到最大,所以CH4即为A的分子式,答:不需要测定其他数据;CH4中H的百分含量已经达到最大,碳原子已经饱和.
(4)由(2)可知,烃A为CH4,则CH4在密闭容器中燃烧生成CO2、CO和水蒸气的反应,其反应的化学方程式为:7CH4+12O2
| ||
(5)由(2)可知,烃A为CH4,CH4在光照条件下,可与Cl2反应,除生成HCl气体外,还可依次生成CH3Cl、CH2Cl2、CHCl3、CCl4,分别写出CH4与Cl2在光照条件下,发生的四个化学反应的化学方程式分别为:CH4+Cl2
| 光 |
| 光 |
CH2Cl2+Cl2
| 光 |
| 光 |
故答案为:
(1)甲;
(2)1:4;
(3)不需要测定其他数据. CH4中H的百分含量已经达到最大,碳原子已经饱和;
(4)7CH4+12O2
| ||
(5)CH4+Cl2
| 光 |
| 光 |
CH2Cl2+Cl2
| 光 |
| 光 |

练习册系列答案
相关题目