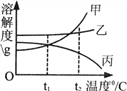
题目内容
【题目】木炭还原氧化铜得到的红色固体是否全部是铜?
[查阅资料]
(1)铜有+1和+2价两种化合价;
(2)C也能将CuO还原为红色固体Cu2O ;
(3)Cu2O + H2SO4 ===== Cu + Cu SO4 + H2O ;
(4)Cu SO4溶液为蓝色。
[猜想] (1)红色固体只是Cu ;(2)红色固体只是Cu2O ;(3)红色固体是____________。
[实验探究]
实验操作 | 实验现象 | 实验结论 |
取3.6g红色固体放入烧杯中,向其中加入足量的稀硫酸充分反应后,静置。 | 若_______________ | 证明猜想(1)正确 |
若_______________ | 证明红色固体中肯定含有____________________ 可能含有_____________ |
为了进一步确定可能含有的物质是否存在,小华将反应后的液体过滤,将滤渣洗涤、干燥,称得其质量为3.5g ,根据上述数据判断猜想__________(填序号)正确。
【答案】 Cu2O Cu 无明显现象 溶液变为蓝色 Cu2O,Cu,CuO ③
【解析】【猜想】木炭还原氧化铜有可能生成铜或氧化亚铜,因此可猜想(3)反应后生成物为:铜与氧化亚铜的混合物;【实验探究】稀硫酸不能与铜发生反应,而氧化亚铜可与稀硫酸反应生成铜、硫酸铜和水;因此,当无现象时,说明固体中只含有铜;而溶液变成蓝色时,说明红色固体中含有氧化亚铜;氧化亚铜与稀硫酸反应生成的铜使溶液中出现的红色铜不能确定原红色粉末中是否一定含有铜;
假设7.2g红色固体全部是Cu2O,反应后生成铜的质量为x
Cu2O+H2SO4═Cu+CuSO4+H2O
144 64
3.6g x
![]()
x=1.6g,比实验中反应后生成的固体质量小;因此判断红色固体全部为铜和氧化亚铜。

练习册系列答案
相关题目