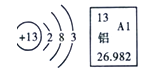
题目内容
【题目】下图是表示某化学反应的微观过程。对该反应的下列说法中,正确的是( )
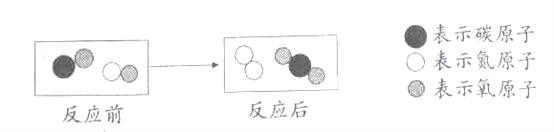
A. 图中有两种氧化物 B. 反应物和生成物均含有毒气体
C. 生成单质与化合物的质量比为7:22 D. 生成单质与化合物的分子数比为1:1
【答案】C
【解析】A、图中四种物质中,只有由2个N原子构成的N2分子属于单质的分子,而其它三种物质的分子都是由氧原子和其它原子构成的氧化物分子,故A不正确;B、该反应的生成物为N2和CO2,两种气体均不是有毒气体;故B不正确;C、根据该反应的化学方程式2CO+2NO═N2+2CO2可知,单质N2与化合物CO2的质量比=28:(2×44)=7:22;故C正确;D、根据该反应的化学方程式2CO+2NO═N2+2CO2可知,生成物的分子个数比为1:2而非1:1;故D不正确。故选C。

【题目】硅钢是制变压器、充电器的核心材料,其主要成分是Fe和Si。某同学用硅钢样品进行如下实验:取6.60 g硅钢样品,将60.00 g稀硫酸分6次加入样品中(其中稀硫酸与硅及其他杂质不反应)。实验测得相关数据如下:
稀硫酸的用量 | 剩余固体的质量 |
第1次加入10.00 g | W g |
第2次加入10.00 g | 4.36 g |
第3次加入10.00 g | 3.24 g |
第4次加入10.00 g | 2.12 g |
第5次加入10.00 g | 1.00 g |
第6次加入10.00 g | 1.00 g |
(1)根据表中数据,稀硫酸加入到第________次,铁恰好反应完全。
(2)表中W=________g。
(3)计算该稀硫酸溶质的质量分数是__________(写出计算过程)。
【题目】木炭还原氧化铜得到的红色固体是否全部是铜?
[查阅资料]
(1)铜有+1和+2价两种化合价;
(2)C也能将CuO还原为红色固体Cu2O ;
(3)Cu2O + H2SO4 ===== Cu + Cu SO4 + H2O ;
(4)Cu SO4溶液为蓝色。
[猜想] (1)红色固体只是Cu ;(2)红色固体只是Cu2O ;(3)红色固体是____________。
[实验探究]
实验操作 | 实验现象 | 实验结论 |
取3.6g红色固体放入烧杯中,向其中加入足量的稀硫酸充分反应后,静置。 | 若_______________ | 证明猜想(1)正确 |
若_______________ | 证明红色固体中肯定含有____________________ 可能含有_____________ |
为了进一步确定可能含有的物质是否存在,小华将反应后的液体过滤,将滤渣洗涤、干燥,称得其质量为3.5g ,根据上述数据判断猜想__________(填序号)正确。