题目内容
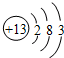 如图是铝的原子结构示意图,回答以下问题:
如图是铝的原子结构示意图,回答以下问题:
(1)铝元素属于______元素.(填“金属”或“非金属”)
(2)铝原子易______电子.(填“得”或“失”)
(3)铝元素在化合物中的化合价为______价.
(4)铝的氧化物的化学式为______.
(5)两个铝离子的符号为______.
(2)该元素的原子最外层含有3个电子,所以在化学反应中易失电子;
(3)由于该元素的原子最外层含有3个电子,所以在化学反应中易失这三个电子而带三个单位的正电荷,可知铝元素在化合物中的化合价为+3价;
(4)氧元素的化合价通常为-2价,铝元素的化合价为+3价,所以铝的氧化物的化学式为Al2O3;
(5)由于该元素的原子最外层含有3个电子,所以在化学反应中易失这三个电子而带三个单位的正电荷,其符号为Mg2+;2个铝离子的符号为2Al3+;
故答案为:(1)金属;(2)失;(3)+3;(4)Al2O3;(5)2Al3+;
分析:由铝元素的原子结构示意图可知:其电子层数、核电荷数、得失电子情况等,进而可以根据得失电子情况判断铝元素在化合物中的化合价和形成的离子.
点评:本题考查学生对原子结构示意图及其特点的理解与掌握,并能灵活应用解题的能力.

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案金属用途广泛,其结构和性质等是化学的重要研究内容。
(1)如图是铝的原子结构示意图。下列说法不正确的是_______。
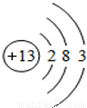
A.铝原子中的质子数为13
B.在化合物中铝通常显+3价
C.铝是地壳中含量最多的元素
D.铝可作导线是由于它具有良好的导电性
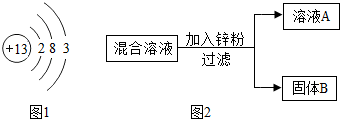
(2)某化学小组用一定量的AgNO3和Cu(NO3)2混合溶液进行了如图实验,并对溶液A和固体B的成分进行了分析和研究。

【提出问题】溶液A中的溶质可能有哪些?
【做出猜想】
① 只有Zn(NO3)2 ② Zn(NO3)2、AgNO3
③ Zn(NO3)2、Cu(NO3)2 ④ Zn(NO3)2、Cu(NO3)2、AgNO3
【交流讨论】不合理的猜想是_______(填标号),其理由是_______。
【实验探究】若猜想①成立,通过以下实验可确定固体B的成分,请将下表填写完整。
|
实验步骤 |
现象 |
实验结论 |
|
取少量固体B,滴加_______ |
有气泡产生 |
固体B含有Cu 、Ag和 _ |
(3)新型材料纳米级 Fe 粉具有广泛的用途,它比普通 Fe 粉更易与氧气反应,其制备工艺流程如图所示:
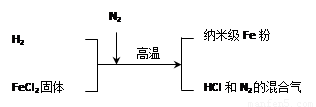
请回答下列问题:
①纳米级Fe粉在空气中易自燃。实验中通入N2的目的是_______。
②写出H2还原FeCl2,置换出铁的化学方程式_______。
③研究人员发现最后制得的纳米级 Fe 粉样品中混有少量的 FeCl2 杂质。取样品20g,加入足量的盐酸,生成氢气 0.7 g。请计算该样品中单质 Fe 的质量分数(请写出计算过程)。_______
金属用途广泛,其结构和性质等是化学的重要研究内容。
 (1)如图是铝的原子结构示意图。下列说法不正确的是_______。
(1)如图是铝的原子结构示意图。下列说法不正确的是_______。
A .铝原子中的质子数为13
.铝原子中的质子数为13
B. 在化合物中铝通常显+3价
在化合物中铝通常显+3价
C.铝是地壳中含量最多的元素
D.铝可作导线是由于它具有良好的导电性
 (2)某化学小组用一定量的AgNO3和Cu(NO3)2混合溶液进行了如图实验,并对溶液A和固体B的成
(2)某化学小组用一定量的AgNO3和Cu(NO3)2混合溶液进行了如图实验,并对溶液A和固体B的成 分进行了分析和研究。
分进行了分析和研究。
【提出问题】溶液A中的溶质可能有哪些?
【做出猜想】
① 只有Zn(NO3)2 ② Zn(NO3)2、AgNO3
③ Zn(NO3)2、Cu(NO3)2 ④ Zn(NO3)2、Cu(NO3)2、AgNO3
【交流讨论】不合理的猜想是_____ __(填标号),其理由是_____ __。
【实验探究】若猜想①成立,通过以下实验可确定固体B的成分,请将下表填写完整。
| 实验步骤 | 现象 | 实验结论 |
| 取少量固体B,滴加_______ | 有气泡产生 | 固体B含有Cu 、Ag和_ |
(3)新型材料纳米级 Fe 粉具有广泛的用途,它比普通 Fe 粉更易与氧气反应,其制备工艺流程如图所示:

请回答下列问题:
①纳米级Fe粉在空气中易自燃。实验中通入N2 的目的是___ ____。
的目的是___ ____。
②写出H2还原FeCl2,置换出铁的化学方程式___ ____。

 (2013?朝阳区一模)金属结构和性质等是化学研究的重要内容.
(2013?朝阳区一模)金属结构和性质等是化学研究的重要内容.