题目内容
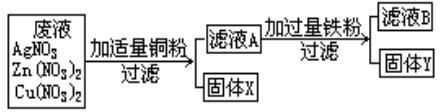
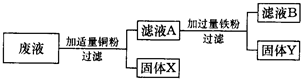
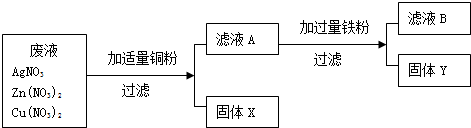
某化工厂排出的废液中含有AgNO3、Cu(NO3)2和Zn(NO3)2.为了减少废液对环境的污染,并回收银和铜,某化学小组同学设计了如图所示方案进行实验:

试回答:
(1)加入的固体a是(写化学式)
(2)固体乙的成分有
(3)步骤①中将滤液1与固体甲分离的操作名称是
(4)写出步骤②中发生反应的化学方程式

试回答:
(1)加入的固体a是(写化学式)
Fe
Fe
.(2)固体乙的成分有
AgCu
AgCu
(3)步骤①中将滤液1与固体甲分离的操作名称是
过滤
过滤
(4)写出步骤②中发生反应的化学方程式
Fe+H2SO4=FeSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
.分析:(1)根据金属活动性顺序的应用,对比废液、滤液的成分分析加入的固体a;
(2)根据上述分析,对比固体甲和滤液的成分分析加入的过量的溶液b,判断固体乙的成分;
(3)过滤是将固液分开的操作;
(4)根据反应写出反应的方程式.
(2)根据上述分析,对比固体甲和滤液的成分分析加入的过量的溶液b,判断固体乙的成分;
(3)过滤是将固液分开的操作;
(4)根据反应写出反应的方程式.
解答:解:(1)由金属活动性顺序的应用,根据废液中含有AgNO3、Cu(NO3)2和Zn(NO3)2加入的固体a后的滤液中只含有Zn(NO3)2、Fe(NO3)2,回收银和铜,加入的固体a应是Fe;
(2)由上述分析可知,向含有AgNO3、Cu(NO3)2和Zn(NO3)2废液加入过量的铁,铁能将铜、银置换出来.得到的固体甲应是铁、铜、银的混合物.为了回收铜银,加入过量的溶液b后过滤得到硫酸亚铁,由此可知加入的溶液b应是稀硫酸,铜、银不与稀硫酸反应,固体乙应是铜、银;
(3)步骤①中将滤液1与固体甲分离的操作名称是过滤;
(4)由上述分析可知,步骤②中发生反应的是铁与硫酸的反应,反应的方程式是:Fe+H2SO4=FeSO4+H2↑.
故答为:(1)Fe; (2)Ag Cu;(3)过滤; (4)Fe+H2SO4=FeSO4+H2↑.
(2)由上述分析可知,向含有AgNO3、Cu(NO3)2和Zn(NO3)2废液加入过量的铁,铁能将铜、银置换出来.得到的固体甲应是铁、铜、银的混合物.为了回收铜银,加入过量的溶液b后过滤得到硫酸亚铁,由此可知加入的溶液b应是稀硫酸,铜、银不与稀硫酸反应,固体乙应是铜、银;
(3)步骤①中将滤液1与固体甲分离的操作名称是过滤;
(4)由上述分析可知,步骤②中发生反应的是铁与硫酸的反应,反应的方程式是:Fe+H2SO4=FeSO4+H2↑.
故答为:(1)Fe; (2)Ag Cu;(3)过滤; (4)Fe+H2SO4=FeSO4+H2↑.
点评:主要考查了金属活动性顺序的应用,根据金属的活动性强弱来判断金属和盐溶液是否发生置换反应,培养学生灵活运用所学知识解决问题的能力.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目