题目内容
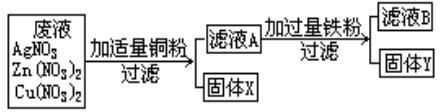
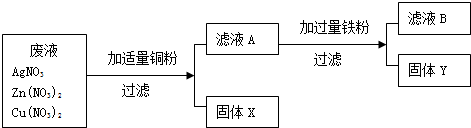
某化工厂排出的废液中含有AgNO3、Zn(NO3)2和Cu(NO3)2三种物质.为了分离并回收金属银和铜,某化学课外小组的同学们设计了如下实验方案:
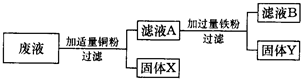
根据以上实验方案你认为(写化学式):固体X是

根据以上实验方案你认为(写化学式):固体X是
Ag
Ag
;固体Y是Fe和Cu的混合物
Fe和Cu的混合物
;滤液B中的溶质是Zn(NO3)2和Fe(NO3)2
Zn(NO3)2和Fe(NO3)2
;写出滤液A到滤液B和固体Y的化学方程式Cu(NO3)2+Fe═Fe(NO3)2+Cu
Cu(NO3)2+Fe═Fe(NO3)2+Cu
.分析:金属和盐溶液反应必须具备:在金属活动性顺序中前面的金属可以把排在它后面的金属从盐溶液中置换出来,结合实验方案分析判断加入的金属能否与废水中的盐液发生的置换反应,进而确定滤渣和滤液的成分即可.
解答:解:由于铜的金属活动性比锌弱,比银强,因此把适量铜粉放到废液中时,铜粉可以和硝酸银发生置换反应,得到金属银,故固体X是Ag;滤液A是硝酸铜和硝酸锌的混合溶液.由于铁的金属活动性比铜强,比锌弱,在把过量的铁粉放入到滤液A中时,铁能和硝酸铜发生置换反应生成铜和硝酸亚铁,反应的化学方程式为Cu(NO3)2+Fe═Fe(NO3)2+Cu;由于铁过量,反应后有剩余,故固体Y是Fe和Cu的混合物;滤液中的溶质是不与铁反应的硝酸锌和反应后生成的硝酸亚铁.
故答案为:Ag;Fe和Cu的混合物;Zn(NO3)2和Fe(NO3)2 ;Cu(NO3)2+Fe═Fe(NO3)2+Cu.
故答案为:Ag;Fe和Cu的混合物;Zn(NO3)2和Fe(NO3)2 ;Cu(NO3)2+Fe═Fe(NO3)2+Cu.
点评:主要考查了金属活动性顺序的应用,根据金属的活动性强弱来判断金属和盐溶液是否发生置换反应,培养学生灵活运用所学知识解决问题的能力.

练习册系列答案
相关题目