题目内容
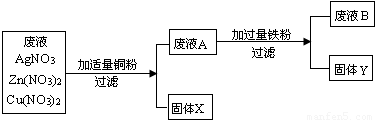
(2007?北京)某化工厂排出的废液中含有AgN03、Zn(NO3)2和Cu(NO3)2三种物质.为了分离并回收金属银和铜,化学课外小组的同学设计了如下实验方案:

根据以上实验方案你认为:固体x是

根据以上实验方案你认为:固体x是
银
银
,固体Y是铁和铜
铁和铜
,滤液B是硝酸锌和硝酸亚铁
硝酸锌和硝酸亚铁
.分析:在金属活动性顺序中,氢前的金属能与酸发生置换反应生成氢气,位置在前的金属能把位于其后的金属从其盐溶液中置换出来.
解答:解:要分离并回收金属银和铜,可以利用金属与盐溶液的反应来进行,加入适量铜粉,能把废液中硝酸银中的银置换出来,所以固体X是银,得到的滤液中含有硝酸锌和硝酸铜,加入过量的铁粉,能与滤液A中的硝酸铜反应生成铜和硝酸亚铁,由于铁过量,反应后有剩余,故所得固体Y中含有铜和铁,滤液B中含有硝酸锌和硝酸亚铁,所以本题答案为:银,铁和铜,硝酸锌和硝酸亚铁.
点评:本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目