题目内容
【题目】某化学实验小组对“影响石灰石与盐酸反应速率的因素”进行了如下探究:
(进行实验)
室温下,选用20mL不同浓度的盐酸(4%和6%)分别与1g粉末状或块状的石灰石进行实验(固定夹持仪器略去)。
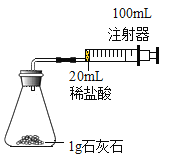
(1)按如图装置进行实验,在装药品前应检查该装置的气密性,具体方法是___________。开始实验时,应将20mL稀盐酸_______________(填“快速”或“缓慢”)推入锥形瓶中,以保证盐酸能全部推入锥形瓶中。
(处理数据)
(2)实验小组进行实验后,获得的相关实验数据如表所示:
实验编号 | 盐酸浓度 (均取20mL) | 石灰石固体形状 (均取1g) | 二氧化碳体积(mL) (均收集前30s的气体) |
a | 4% | 粉末状 | 64 |
b | 4% | 块状 | 40 |
c | 6% | 粉末状 | 98 |
d | 6% | 块状 | 65 |
①要准确比较不同形状的石灰石对反应速率的影响,可采用的方法是____________(写一种);
②从上述实验中得出的结论是颗粒越小,反应的速率越大______________。
(3)如表是实验时记录生成的二氧化碳气体体积和对应的时间的一组实验数据(每间隔4s读数一次):
时间/s | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 32 | 36 | 40 |
气体体积/mL | 16 | 22 | 29 | 39 | 50 | 57 | 62 | 64 | 66 | 66 |
从如表数据可以分析得出,到20s后反应速率逐渐变慢,其主要原因是_____________。
(拓展延伸)
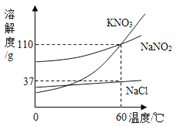
(4)比较不同形状的碳酸钙与稀盐酸反应的速率:利用如图1装置进行实验,同学们倾斜锥形瓶,使试管内的稀盐酸流入瓶中与碳酸钙发生反应,测得瓶内气压随时间的变化如图2所示。
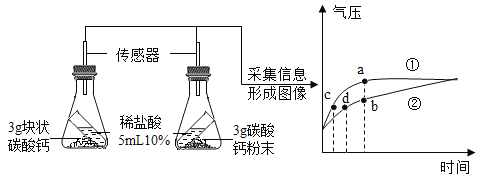
分析图象可知b点溶质______________(填化学式);c、d对比的目的___________________
【答案】将注射器活塞向外拉出一段,松开手一会后,若活塞又回到原位,证明装置气密性良好 快速 ab或cd 相同条件下,碳酸钙颗粒越小,反应的速率越大 随着反应的进行盐酸浓度减小,反应速率逐渐变慢 CaCl2、HCl 对比c、d点可知,相同的气压时,c所需的时间短,说明单位时间内产生的气体多,反应速率快
【解析】
(1)在装药品前应检查该装置的气密性,具体的做法是将将注射器活塞向外拉出一段,松开手一会后,若活塞又回到原位,证明装置气密性良好;开始实验时,因为盐酸和碳酸钙反应生成的二氧化碳会使装置内的压强增大,故应将20ml的稀盐酸快速的推入锥形瓶中,以保证盐酸能全部推入锥形瓶中。
处理数据
(2)①要比较不同形状的石灰石对反应速率的影响,需要盐酸的溶质质量分数相同,石灰石固体的颗粒不相同,比较相同时间内,收集气体体积大小,体积越大,说明反应速率越快,故可选择的实验编号是ab或是cd;
②根据实验编号ab或cd比较,同条件下,当颗粒大小不同时,颗粒越小,反应的速率越大。
(3)从表格数据可以分析得出,开始反应的速率大,后来的反应速率小,主要是因为随着反应的进行,反应物被消耗,浓度减小。
(4)曲线①单位时间内气压大,说明单位时间内产生的气体多,反应速率快,曲线①表示粉末状碳酸钙与稀盐酸反应,曲线②表示块状碳酸钙与稀盐酸反应,最终曲线①、②的气压相等,是因为反应物的量相同,最终产生的二氧化碳质量相等;分析图象可知b点时稀盐酸和碳酸钙已经反应了一段时间,但还未反应结束,故此时的溶质为生成的氯化钙和还未反应的氯化氢(碳酸钙虽剩余但为固体,不存在溶液中);c、d两点的纵坐标相同,横坐标不同,对比c、d点可知,相同的气压时,c所需的时间短,说明单位时间内产生的气体多,反应速率快。

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
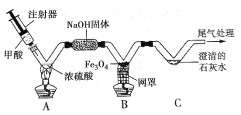
黄冈小状元同步计算天天练系列答案【题目】(8分)常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物。
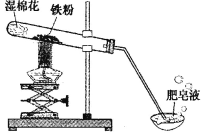
(1)试管尾部放一团湿棉花的目的是_______________。
(2)探究生成的气体是什么?
用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。 说明生成的气体是______________。
(3)探究试管中剩余固体成分是什么?
【查阅资料】
常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
能否被磁铁吸引 | 否 | 否 | 能 |
【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引。
【猜想与假设】猜想一:剩余固体是Fe与Fe3O4;猜想二:剩余固体是_____________。
【实验探究】
实验操作 | 实验现象及结论 |
【实验结论】铁和水蒸气反应的化学方程式为___________________________________。
【反思与交流】该黑色固体不可能是Fe2O3,理由是_______________________________。