题目内容
【题目】自来水厂常使用“漂白粉”来杀菌消毒。“漂白粉”的有效成分为次氯酸钙[化学式为Ca(ClO)2].请回答:
(1)漂白粉是_____(填“纯净物”或“混合物”)。
(2)次氯酸钙中钙、氯、氧三种元素的原子个数比为_____。
(3)次氯酸钙中钙、氯、氧三种元素的质量比为_____。
(4)次氯酸钙中氯元素的质量分数是_____(结果精确到0.1%)。
【答案】混合物 1:2:2 40:71:32 49.7%。
【解析】
根据化学式的意义进行相关的计算,注意要结合题目要求以及使用正确的相对原子质量进行分析和解答。
(1)漂白粉的主要成分是次氯酸钙,所以漂白粉是混合物;
(2)次氯酸钙中钙、氯、氧三种元素的原子个数比为1:2:2;
(3)次氯酸钙中钙、氯、氧三种元素的质量比为40:(35.2×2):(16×2)=40:71:32;
(4)次氯酸钙中氯元素的质量分数是![]() ×100%≈49.7%。
×100%≈49.7%。

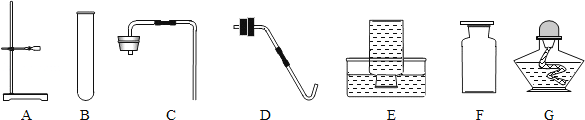
【题目】探究氯酸钾和二氧化锰制氧气实验中反应物与催化剂的最佳质量比.
实验中采用图1实验装置,取20g氯酸钾,分成10等份,每份2g,分别装入10支试管中.在10支试管中分别加入不同质量的二氧化锰,分别测量二氧化锰与氯酸钾在不同质量比时,生成200ml氧气所消耗的时间.实验记录的数据如下:
实验编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
二氧化锰的质量(g) | 0.1 | 0.2 | 0.33 | 0.4 | 0.5 | 0.66 | 1 | 1.3 | 2 | 3 |
二氧化锰与氯酸钾的质量比 | 1:20 | 1:10 | 1:6 | 1:5 | 1:4 | 1:3 | 1:2 | 2:3 | 1:1 | 3:2 |
生成200ml氧气时间(秒) | 235 | 186 | 162 | 147 | 133 | 117 | 143 | 160 | 211 | 244 |
请回答下列问题:
(1)为完成本实验,方框内应选择图2气体收集装置中的是_____(选填序号)该收集利用了氧气的_____性质.收集气体前集气瓶内未装满水,对实验结果_____(填“有”或“没有”)影响.
(2)分析上述数据,你认为利用此法制氧气,二氧化锰与氯酸钾的最佳质量比为_____.
(3)利用双氧水和二氧化锰的混合物制氧气比加热氯酸钾和二氧化锰混合物制氧气更好,请写出前者的两个优点①_____②
(4)催化剂能影响化学反应速度,温度、反应物的浓度、接触面积等也会对化学反应速度带来影响.分析上表数据,结合影响化学反应速度的
①当二氧化锰与氯酸钾的质量比高于最佳质量比时,反应速度变低的原因是_____.
②当二氧化锰与氯酸钾的质量比低于最佳质量比时,反应速度变低的原因是_____.
【题目】某兴趣小组的同学们在探究“可燃物燃烧的条件”时,通过查阅资料知:白磷的着火点是40℃,红磷的着火点是240℃,…燃烧产物五氧化二磷是白色固体,刺激人体呼吸道,吸入过量可引起中毒性肺炎.于是他们对装置甲进行了改进,如装置乙所示,a、b试管口均为胶塞.请按要求回答相关问题.
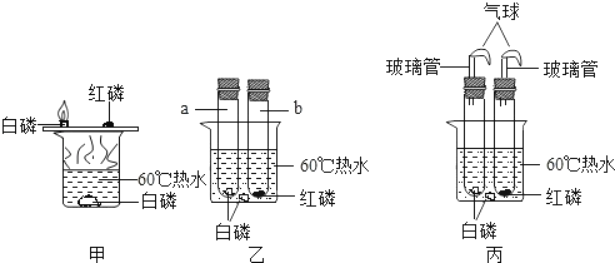
(实验操作)
(1)装置甲中白磷燃烧的化学方程式是_____.
(2)同学们按装置乙进行实验.请你版主他们完成下列表格.
观察到的现象 | 解释 |
a试管中白磷_____ 热水中白磷_____ | 热水中白磷产生这种现象的原因是_____ |
b试管中红磷_____ | B试管中红磷产生这种现象的原因是_____ |
(反思与评价)
(3)装置乙与装置甲比较,其优点是_____.
(4)有同学指出装置乙仍有不足之处,并设计了装置丙,其中气球的作用是:_____.
(拓展与迁移)
(5)实验室的化学药品不慎起火,常将沙土铺撒在燃烧的药品上,其作用是_____.
(6)保存少量白磷的方法是_____.
【题目】某校化学兴趣小组的同学在老师的指导下做了有关氧气探究实验:
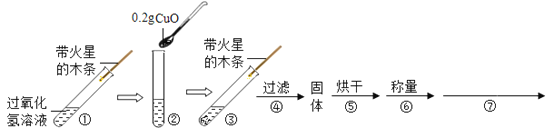
学习了二氧化锰对过氧化氢分解有催化作用的知识后,某同学想:CuO(氧化铜)能否起类似二氧化锰的催化作用呢?于是进行了以下探究。
(猜想与假设)
Ⅰ.CuO不是过氧化氢分解反应的催化剂
Ⅱ.CuO是过氧化氢分解反应的催化剂。
(实验探究)用天平称量0.2gCuO,取5mL5%的过氧化氢溶液于试管中,进行如下实验:
(1)
步骤③现象 | 步骤⑥结果 | 步骤⑦ | 结论 |
_____ | _____ | _____ | 猜想I不成立; 猜想Ⅱ成立。 |
(2)能证明CuO加快了过氧化氢分解速率的实验步骤是_____;
(3)证明CuO是过氧化氢分解的催化剂,需通过步骤⑦说明_____;
(4)小组同学通过互联网得知,CuSO4溶液也能显著加快过氧化氢的分解,CuSO4溶液主要含有三种粒子(H2O、Cu2+、SO42-),稀硫酸中含有三种粒子(H2O、H+、SO42-),为了进一步探究CuSO4,溶液中哪种粒子能起催化作用,小组同学作了以下分析和设计。
①小组同学认为最不可能的是H2O,他们的理由是_____;
②要说明另外的两种粒子是否起到催化作用小组同学设计了如下实验,完成探究活动。
实验步骤 | 实验现象 | 结论 |
a.取一支试管加入5mL5%过氧化氢溶液,然后加入2-3滴稀硫酸 | 溶液几乎没有气泡放出 | 实验证明,起催化作用的是_____ 。 |
b.另取一支试管加入5mL5%过氧化氢溶液,然后加入2-3滴硫酸铜溶液 | 溶液中有大量气泡放出 |
【题目】在化学实验室,某小组同学实验时发现一瓶没有密封好的 NaOH 已经结块。于是对其成分进行科学探究,请你一起完成探究的过程。
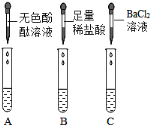
Ⅰ固体的成分分析
(提出问题)结块后的固体成分是什么?
(猜想与假设)
猜想一:固体为碳酸钠
猜想二:固体为碳酸钠和氢氧化钠。
用化学方程式表示固体中含有碳酸钠的原因______________
(查阅资料)BaCl2 溶液 pH=7。
(实验探究)从瓶中取出一定量的固体,加入足量水溶解,再将溶液分三等份分别装入A、B、C 三支试管,进行如上图所示实验。
甲同学根据实验现象,认为结块固体中有碳酸钠和氢氧化钠。
(实验分析)
(1) 根据甲同学的实验结论可知,三支试管中观察到的实验现象分别为:A 试管中_______________________,B 试管出现大量气泡,C 试管中出现白色沉淀; C 试管中现象产生的原因是(用化学方程式表示)______________
(2)乙同学认为甲同学的结论是不正确的,原因是______________
(实验设计)请你设计合理的实验方案,填入下列表格中。
操作 | 现象 | 结论 |
取少量结块固体于试管(或烧杯)中, 加水使其完全溶解, ①______________ ②______________ | ①______________ ②______________ | 固体为碳酸钠和 氢氧化钠 |
Ⅱ 固体中各成分含量
为确定该固体样品中 Na2CO3 的质量分数,小芳同学称取 2 g 样品,利用 A 为 Y 形管、B为量气管、C 为水准管作为主要反应容器,进行了如图(I)所示实验。
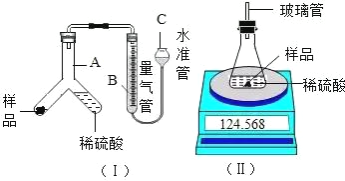
(1)在量气管内水面上加一薄层油,目的是______________
(2)使样品与稀硫酸反应的操作为______________
(3)实验结束后,小芳同学读出量气管中的气体体积为 22.4ml(已知该温度压强下,CO2的密度为 1.965 g/L),请你计算出样品中 Na2CO3 质量分数______________。(写出计算过程)
(4)小明同学设计如图(Ⅱ)装置,分别测定反应前、反应后仪器以及仪器内物质的总质量,进行有关计算,实验操作中没有失误,多次测量的结果均偏大,你认为可能的原因是______________