题目内容
【题目】在化学实验室,某小组同学实验时发现一瓶没有密封好的 NaOH 已经结块。于是对其成分进行科学探究,请你一起完成探究的过程。
Ⅰ固体的成分分析
(提出问题)结块后的固体成分是什么?
(猜想与假设)
猜想一:固体为碳酸钠
猜想二:固体为碳酸钠和氢氧化钠。
用化学方程式表示固体中含有碳酸钠的原因______________
(查阅资料)BaCl2 溶液 pH=7。
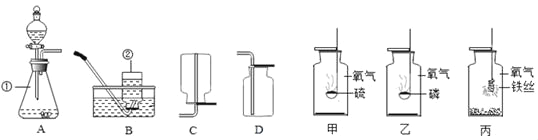
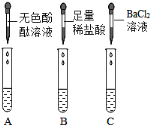
(实验探究)从瓶中取出一定量的固体,加入足量水溶解,再将溶液分三等份分别装入A、B、C 三支试管,进行如上图所示实验。
甲同学根据实验现象,认为结块固体中有碳酸钠和氢氧化钠。
(实验分析)
(1) 根据甲同学的实验结论可知,三支试管中观察到的实验现象分别为:A 试管中_______________________,B 试管出现大量气泡,C 试管中出现白色沉淀; C 试管中现象产生的原因是(用化学方程式表示)______________
(2)乙同学认为甲同学的结论是不正确的,原因是______________
(实验设计)请你设计合理的实验方案,填入下列表格中。
操作 | 现象 | 结论 |
取少量结块固体于试管(或烧杯)中, 加水使其完全溶解, ①______________ ②______________ | ①______________ ②______________ | 固体为碳酸钠和 氢氧化钠 |
Ⅱ 固体中各成分含量
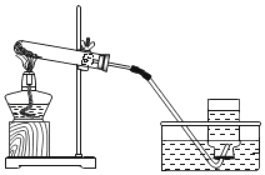
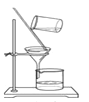
为确定该固体样品中 Na2CO3 的质量分数,小芳同学称取 2 g 样品,利用 A 为 Y 形管、B为量气管、C 为水准管作为主要反应容器,进行了如图(I)所示实验。
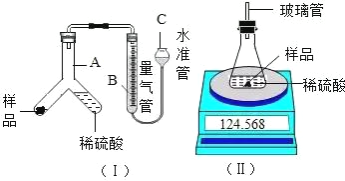
(1)在量气管内水面上加一薄层油,目的是______________
(2)使样品与稀硫酸反应的操作为______________
(3)实验结束后,小芳同学读出量气管中的气体体积为 22.4ml(已知该温度压强下,CO2的密度为 1.965 g/L),请你计算出样品中 Na2CO3 质量分数______________。(写出计算过程)
(4)小明同学设计如图(Ⅱ)装置,分别测定反应前、反应后仪器以及仪器内物质的总质量,进行有关计算,实验操作中没有失误,多次测量的结果均偏大,你认为可能的原因是______________
【答案】CO2+2NaOH═Na2CO3+H2O; 溶液变红 Na2CO3+BaCl2=BaCO3↓+2NaCl 碳酸钠溶液呈碱性,也使无色酚酞变红,不能判断样品中是否含有氢氧化钠 加入过量氯化钡溶液,静置 滴加酚酞试液 产生白色沉淀 溶液变红色 防止二氧化碳溶于水 将Y形管(装置A)向左倾斜,硫酸流到样品中 5.3% 逸出的二氧化碳中含有水蒸汽
【解析】
Ⅰ固体的成分分析
氢氧化钠容易潮解,然后会和二氧化碳发生反应而生成了碳酸钠和水,其化学方程式为:CO2+2NaOH═Na2CO3+H2O;
实验
(1)碳酸钠和氢氧化钠溶液都呈碱性,碳酸钠与盐酸反应生成氯化钠、水和二氧化碳;碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠,根据甲同学得出的结论可以知道:三支试管中观察到的实验现象分别为:A中溶液变红,说明溶液显碱性,B中有气泡产生,C中溶液变浑浊,判断了碳酸钠的存在;C 试管中现象产生的原因是:Na2CO3+BaCl2=BaCO3↓+2NaCl(用化学方程式表示);
(2)碳酸钠溶液也呈碱性,可以使酚酞变红,所以不能仅仅根据A中溶液变红来判断氢氧化钠的存在;
实验设计:
为了确认氢氧化钠的存在,必须先除去碳酸钠,根据碳酸钠的性质可以设计实验为:取少量结块固体于试管(或烧杯)中,加水使其完全溶解,再向其中加入过量的氯化钡溶液,静置后,向上层清液(或过滤后向滤液)中滴加几滴无色酚酞溶液;若固体为碳酸钠和氢氧化钠,加入氯化钡溶液,产生白色沉淀;滴入酚酞溶液变红;
操作 | 现象 | 结论 |
取少量结块固体于试管(或烧杯)中, 加水使其完全溶解, ①加入过量氯化钡溶液,静置 ②滴加酚酞试液 | ①产生白色沉淀 ②溶液变红色 | 固体为碳酸钠和 氢氧化钠 |
Ⅱ.固体中各成分含量
(1)二氧化碳能溶于水,油层能有效防止二氧化碳溶于水;
(2)要使样品与稀硫酸反应,可将Y形管(装置A)向左倾斜,硫酸流到样品中;
(3)生成CO2的质量=(22.4mL÷1000)×1.964g/L≈0.044g;
设:样品中的Na2CO3的质量为x。
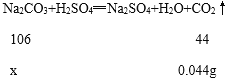
![]()
x=0.106g;
所以样品中的Na2CO3的质量分数=![]() ;
;
(4)实验操作中没有失误,多次测量的结果均偏大,可能的原因是逸出的二氧化碳中含有水蒸汽。