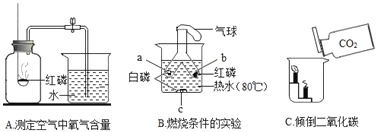
题目内容
【题目】下图是元素周期表的一部分,请仔细分析图中的信息并回答有关问题。
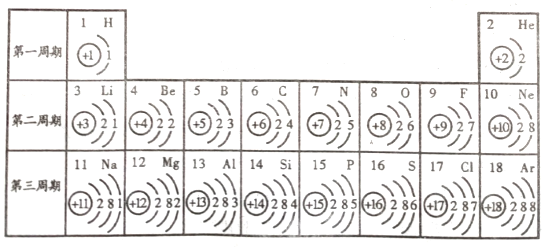
(1)下列各组具有相似化学性质的元素是_________________(填字母序号);
A Na、Cl
B O、S
C He、Mg
D Cl、Ar
(2)写出一条第三周期元素原子的核外电子排布规律_________________;
(3)第8号元素与第13号元素形成化合物的化学式为____________;
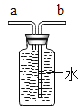
(4)某粒子的结构示意图如下,当x-y=8时,该粒子的符号为___________;
![]()
(5)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的结构和性质,下列各组粒子中属于等电子体的是__________(填字母序号)。
A NO和O2
B CO和N2
C SO2和CO2
【答案】B 从左至右,最外层电子数依次递增 Al2O3 S2- B
【解析】
(1)最外层电子数决定元素的化学性质。
A Na原子最外层电子数为1;Cl原子最外层电子数为7,化学性质不相似;
B O原子和S原子的最外层均为6个电子,化学性质相似;
C He原子和Mg原子的最外层均为2个电子,但He最外层已达到稳定结构,Mg原子在化学变化易失去两个电子形成稳定结构,化学性质不相似;
D Cl原子的最外层均为7个电子;Ar原子的最外层电子数为8,化学性质不相似。故填B;
(2)根据元素周期表可知,第三周期元素原子的最外层电子数从1到8依次递增,核外电子层数相同;
(3)某粒子的结构示意图为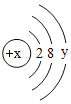 ,当x-y=8时,说明该微粒是带有2个单位负电荷的离子,该粒子是硫离子,离子符号为:S2-;
,当x-y=8时,说明该微粒是带有2个单位负电荷的离子,该粒子是硫离子,离子符号为:S2-;
(4)A NO的电子数=7+8=15,O2的电子数=8+8=16,不是等电子体;
B CO和N2的原子数相同,电子数都是14,是等电子体;
C SO2和CO2的原子数相同,电子数分别为32、22,不是等电子体;故填:B。

 阅读快车系列答案
阅读快车系列答案【题目】一定条件下,在密闭容器内投入SO2、O2、SO3、V2O5四种物质,发生反应的化学方程式为2SO2+O2![]() 2SO3。在不同时刻测得容器内各物质的质量如下表所示,下列说法不正确的是
2SO3。在不同时刻测得容器内各物质的质量如下表所示,下列说法不正确的是
物质 | 甲 | 乙 | 丙 | 丁 |
t1 | 80g | 5g | 100g | 5g |
t2 | a | 55g | 60g | b |
t3 | c | d | 40g | 5g |
A.甲是O2,丁是V2O5
B.a = 70g,d = 25g
C.参加反应的SO2、O2的分子个数比为2︰1
D.参加反应的SO2、O2的质量比为4︰1
【题目】某化学兴趣小组在实验室用氯酸钾和二氧化锰混合加热制取氧气时,发现制得的气体有刺激性气味,于是在老师的指导下对该气体成分进行探究.
【提出问题】氯酸钾与二氧化锰混合加热后产生的气体成分是什么?
【查阅资料】
(1)氯酸钾与二氧化锰混合加热产生的气体只以单质形式存在;
(2)氯气(Cl2)是有刺激性气味的气体,能溶于水,能使湿润的淀粉碘化钾试纸变蓝.
【猜想与假设】猜想一:该气体为O2;猜想二:该气体为Cl2;猜想三:该气体为_____________.
【实验探究】
序号 | 实验操作 | 实验现象 | 实验结论 |
1 | 小丽用排水集气法收集A、B两瓶气体,将带火星木条伸入A中;湿润的淀粉碘化钾试纸伸入B中 | A中带火星木条复燃,B中淀粉碘化钾试纸不变色 | 猜想____成立 |
2 | 小岚用向上排空气法收集C、D两瓶气体,将带火星木条伸入C中,湿润的淀粉碘化钾试纸伸入D中 | C中带火星木条复燃,D中淀粉碘化钾试纸_______ | 猜想三成立 |
【反思与评价】
(1)小涛认为小丽的结论不正确,原因是___________________________.
(2)还可用更简便的方法检验Cl2的存在,该方法是__________________________________________.
【拓展应用】
(1)若取氯酸钾和二氧化锰混合加热后的少量固体,加入足量水溶解,过滤,滤液成紫红色,该现象说明反应还生成了__________(填化学式).
(2)MnO2不仅能作催化剂还可以作反应物,实验室通常用MnO2与浓盐酸共热制取Cl2.请完成该反应的化学方程式:MnO2+4HCl(浓)![]() MnCl2+________+Cl2↑.
MnCl2+________+Cl2↑.