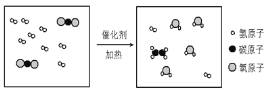
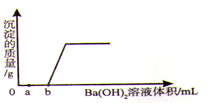
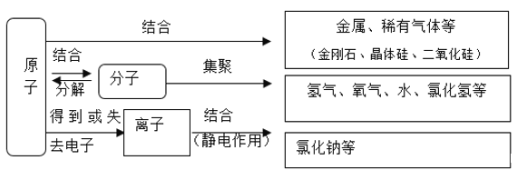
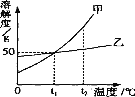
题目内容
【题目】在实验室配制50g5%氯化钠溶液后,请回答下列问题:
①配制过程的步骤是:_____、称取、量取、溶解、转移.
②应该称取的氯化钠质量为_____g,用已调节平衡的托盘天平称取氯化钠时,发现指针偏左,接下来的操作是_____.
A添加氯化钠 B减少氯化钠 C调节平衡螺母 D添加砝码
③已知常温下水的密度为1g/mL.则应该使用_____(填仪器名称)去量取_____mL的水.在量取水的体积时,若仰视读数,则会导致氯化钠溶液的溶质质量分数_____ (填“>”或“<”)5%.
④在溶解步骤中需要的仪器有_____、_____.
【答案】计算 2.5 B 量筒 47.5 > 烧杯 玻璃棒
【解析】
溶质质量=溶液质量×溶质的质量分数,溶剂质量=溶液质量-溶质质量。
①实验室配制50g 5%氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解。
②溶质质量=溶液质量×溶质的质量分数,50g 5%氯化钠溶液,需氯化钠的质量为
![]() 。托盘天平称取未知质量药品,步骤是:调节天平平衡,在右盘上加砝码,天平指针偏左,说明药品的质量大于砝码质量,应减少氯化钠,直至天平平衡,故选B。
。托盘天平称取未知质量药品,步骤是:调节天平平衡,在右盘上加砝码,天平指针偏左,说明药品的质量大于砝码质量,应减少氯化钠,直至天平平衡,故选B。
③溶剂质量=溶液质量﹣溶质质量,则所需水的质量为![]() (合47.5mL),从减小实验误差的角度去选择量筒的量程,量筒量程选择的依据有两点:一是保证测量一次,二是量程要与液体的取用量最接近.应该使用量筒去量取47.5mL水;在量取水的体积时,若仰视读数,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏大,故会导致氯化钠溶液的溶质质量分数>5%。
(合47.5mL),从减小实验误差的角度去选择量筒的量程,量筒量程选择的依据有两点:一是保证测量一次,二是量程要与液体的取用量最接近.应该使用量筒去量取47.5mL水;在量取水的体积时,若仰视读数,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏大,故会导致氯化钠溶液的溶质质量分数>5%。
④在溶解步骤中需要的仪器有烧杯、玻璃棒。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】在一个密闭的容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量,数据见下表.下列说法错误的是( )
物 质 | 甲 | 乙 | 丙 | 丁 |
反应前质量/g | 2 | 20 | 14 | 2 |
反应后质量/g | m | 28 | 0 | 8 |
A.m的值是2B.甲可能是该反应的催化剂
C.反应的乙、丁质量比是4:3D.该反应是化合反应
【题目】在一个密闭容器中放入X、Y、Z、W四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表:
物 质 | X | Y | Z | W |
反应前的质量(g) | 20 | m | 16 | 14 |
反应后的质量(g) | 4 | 6 | 60 | 50 |
下列关于此反应的认识,正确的是( )
A.m的数值为64
B.Z和W的相对分子质量之比为11:9
C.参加反应的X与Y的质量比为1:4
D.若X为化合物,Y为单质,则该反应一定为置换反应