题目内容
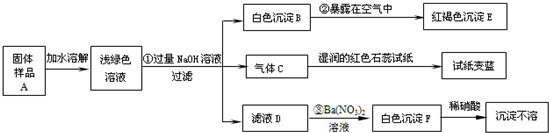
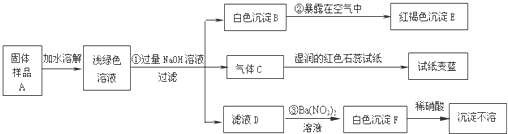
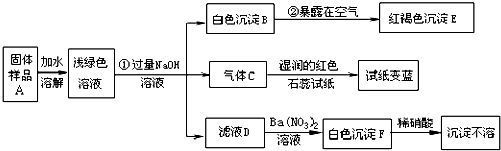
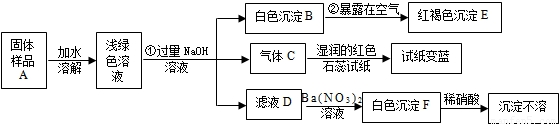
某地新建一化工厂有一种产品属于“复盐”,该产品可用作铁树、棕榈等花木的肥料.某化学课外兴趣小组探究该产品的组成,进行了如下的实验:(查阅资料获知:“复盐”是指由两种阳离子和一种酸根离子组成的盐.如光卤石(KCl?MgCl2?6H2O)).
试回答下列问题:
(1)写出下列物质的化学式:C______、E______、F______
(2)写出下列变化的化学方程式:
②______ ③______
(3)上述探究结果说明样品A中含有的离子有______.
解:(1)气体C能使湿润的红色石蕊试纸变蓝,说明该气体显碱性,又因为是加入氢氧化钠得到的碱性气体,所以气体C是氨气,红褐色沉淀就是氢氧化铁沉淀,白色沉淀加入硝酸沉淀不溶解,说明该白色沉淀可能是硫酸钡或氯化银沉淀,又因为是加入硝酸钡后得到的白色沉淀,没有出现银离子,所以白色沉淀是硫酸钡;
(2)由于浅绿色溶液中含有亚铁离子,所以加入氢氧化钠后得到氢氧化亚铁白色沉淀,所以第②个反应的反应物是氢氧化亚铁、氧气、水生成物是氢氧化铁,利用奇偶法配平即可;由加入硝酸钡后得到的白色沉淀,加入硝酸白色沉淀不溶解,说明该白色沉淀是硫酸钡沉淀,说明滤液D中含有硫酸根离子,又因为前面加入了过量的氢氧化钠,所以阳离子有钠离子,所以滤液D中含有硫酸钠,所以第③个反应的反应物是硫酸钠和硝酸钡,生成物是硫酸钡和硝酸钠,用观察法配平即可;
(3)固体样品加入水中,得到浅绿色溶液说明固体样品中含有亚铁离子,气体C能使湿润的红色石蕊试纸变蓝,说明该气体显碱性,又因为是加入氢氧化钠得到的碱性气体,所以气体C是氨气,氢氧根离子与铵根离子结合能产生氨气,所以说明固体样品中含有铵根离子,由加入硝酸钡后得到的白色沉淀,加入硝酸白色沉淀不溶解,说明该白色沉淀是硫酸钡沉淀,说明滤液D中含有硫酸根离子,说明固体样品中含有硫酸根离子.
故答案为:(1)NH3;Fe(OH)3;BaSO4;
(2)②4Fe(OH)2+O2+2H2O═4Fe(OH)3
③Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3
(3)Fe2+、NH4+、SO42-.
分析:根据浅绿色溶液是亚铁离子的溶液,红褐色沉淀是氢氧化铁沉淀,白色沉淀加入硝酸沉淀不溶解,说明该白色沉淀可能是硫酸钡或氯化银沉淀等现象,再结合所给信息进行具体分析即可得出结论.
点评:在做推断题时要找出突破口,根据学过去的知识经验来考虑本题,知道浅绿色溶液属于亚铁离子溶液,红褐色沉淀是氢氧化铁沉淀,碱性气体有氨气,常见蓝色溶液是铜离子溶液,不溶于硝酸的白色沉淀有硫酸钡和氯化银两种沉淀.
(2)由于浅绿色溶液中含有亚铁离子,所以加入氢氧化钠后得到氢氧化亚铁白色沉淀,所以第②个反应的反应物是氢氧化亚铁、氧气、水生成物是氢氧化铁,利用奇偶法配平即可;由加入硝酸钡后得到的白色沉淀,加入硝酸白色沉淀不溶解,说明该白色沉淀是硫酸钡沉淀,说明滤液D中含有硫酸根离子,又因为前面加入了过量的氢氧化钠,所以阳离子有钠离子,所以滤液D中含有硫酸钠,所以第③个反应的反应物是硫酸钠和硝酸钡,生成物是硫酸钡和硝酸钠,用观察法配平即可;
(3)固体样品加入水中,得到浅绿色溶液说明固体样品中含有亚铁离子,气体C能使湿润的红色石蕊试纸变蓝,说明该气体显碱性,又因为是加入氢氧化钠得到的碱性气体,所以气体C是氨气,氢氧根离子与铵根离子结合能产生氨气,所以说明固体样品中含有铵根离子,由加入硝酸钡后得到的白色沉淀,加入硝酸白色沉淀不溶解,说明该白色沉淀是硫酸钡沉淀,说明滤液D中含有硫酸根离子,说明固体样品中含有硫酸根离子.
故答案为:(1)NH3;Fe(OH)3;BaSO4;
(2)②4Fe(OH)2+O2+2H2O═4Fe(OH)3
③Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3
(3)Fe2+、NH4+、SO42-.
分析:根据浅绿色溶液是亚铁离子的溶液,红褐色沉淀是氢氧化铁沉淀,白色沉淀加入硝酸沉淀不溶解,说明该白色沉淀可能是硫酸钡或氯化银沉淀等现象,再结合所给信息进行具体分析即可得出结论.
点评:在做推断题时要找出突破口,根据学过去的知识经验来考虑本题,知道浅绿色溶液属于亚铁离子溶液,红褐色沉淀是氢氧化铁沉淀,碱性气体有氨气,常见蓝色溶液是铜离子溶液,不溶于硝酸的白色沉淀有硫酸钡和氯化银两种沉淀.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目