题目内容
化学物质之间的反应奥妙无穷.在一次化学探究活动中,同学们从不同角度对稀硫酸与氢氧化钠溶液的反应进行了探究,请你参与并填写以下空白.
(1)如何用实验验证稀硫酸与氢氧化钠溶液发生了反应
第一组同学设计了实验方案一:
①请你分析上述方案中为什么强调只有测得的PH≥7才能证明反应发生了?
②写出稀硫酸与氢氧化钠溶液反应的化学方程式
(2)设计实验,探究稀硫酸与氢氧化钠溶液的反应是否放热
实验仪器与药品:10%的硫酸、10%的氢氧化钠溶液、烧杯、温度计、玻璃棒、胶头滴管.
请你完成实验方案设计:
(3)探究稀硫酸与氢氧化钠溶液是否恰好完全反应
第二组同学在做完稀硫酸与氢氧化钠溶液反应的实验后,为探究稀硫酸与氢氧化钠溶液是否恰好完全反应.
设计了实验方案二:
此时有同学提出方案二不能证明稀硫酸与氢氧化钠溶液恰好完全反应,其原因是
能力提升:
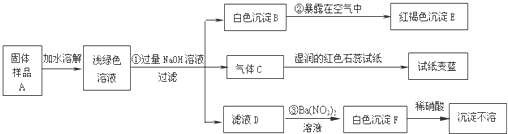
某地新建一化工厂有一种产品属于“复盐”,该产品可用作铁树、棕榈等花木的肥料.某化学课外兴趣小组探究该产品的组成,进行了如下的实验:(查阅资料获知:“复盐”是指由两种阳离子和一种酸根离子组成的盐.如光卤石(KCl?MgCl2?6H2O)).
试回答下列问题:
(1)写出下列物质的化学式:C
(2)写出下列变化的化学方程式:
②
(3)上述探究结果说明样品A中含有的离子有
(1)如何用实验验证稀硫酸与氢氧化钠溶液发生了反应
第一组同学设计了实验方案一:
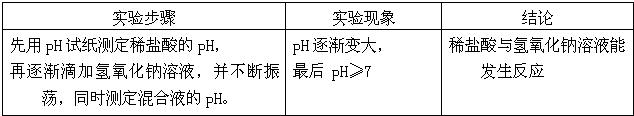
| 实验步骤 | 实验现象 | 结论 |
| 先用PH试纸测定稀硫酸的PH,再逐渐滴加氢氧化钠溶液,并不断振荡,同时测定混合液的PH. | PH逐渐变大, 最后 PH≥7 |
稀硫酸与氢氧化钠溶液能发生反应 |
排除因氢氧化钠溶液的加入,稀释硫酸而引起PH变大
排除因氢氧化钠溶液的加入,稀释硫酸而引起PH变大
或只有PH≥7才能说明硫酸已经反应掉了
或只有PH≥7才能说明硫酸已经反应掉了
.②写出稀硫酸与氢氧化钠溶液反应的化学方程式
2NaOH+H2SO4=Na2SO4+2H2O
2NaOH+H2SO4=Na2SO4+2H2O
.(2)设计实验,探究稀硫酸与氢氧化钠溶液的反应是否放热
实验仪器与药品:10%的硫酸、10%的氢氧化钠溶液、烧杯、温度计、玻璃棒、胶头滴管.
请你完成实验方案设计:
| 实 验 步 骤 | 实验现象 | 结论 |
| 稀硫酸与氢氧化钠溶液反应放热 |
第二组同学在做完稀硫酸与氢氧化钠溶液反应的实验后,为探究稀硫酸与氢氧化钠溶液是否恰好完全反应.
设计了实验方案二:
| 实验步骤 | 实验现象 | 结论 |
| 取少量上述反应后的溶液于试管中,滴加硫酸铜溶液. | 若 生成蓝色沉淀 生成蓝色沉淀 |
氢氧化钠溶液过量 |
| 若没有明显现象 | 稀硫酸与氢氧化钠溶液恰好完全反应 |
若盐酸过量,加入硫酸铜溶液时也无明显现象(或硫酸可能有剩余);
若盐酸过量,加入硫酸铜溶液时也无明显现象(或硫酸可能有剩余);
.为此,还需要选择紫色石蕊试液(或锌粒、碳酸钠、氧化铜、氢氧化铜、pH试纸等).
紫色石蕊试液(或锌粒、碳酸钠、氧化铜、氢氧化铜、pH试纸等).
(填一种试剂),再进行实验即可.能力提升:
某地新建一化工厂有一种产品属于“复盐”,该产品可用作铁树、棕榈等花木的肥料.某化学课外兴趣小组探究该产品的组成,进行了如下的实验:(查阅资料获知:“复盐”是指由两种阳离子和一种酸根离子组成的盐.如光卤石(KCl?MgCl2?6H2O)).

试回答下列问题:
(1)写出下列物质的化学式:C
NH3
NH3
、EFe(OH)3
Fe(OH)3
、FBaSO4
BaSO4
(2)写出下列变化的化学方程式:
②
4Fe(OH)2+O2+2H2O═4Fe(OH)3
4Fe(OH)2+O2+2H2O═4Fe(OH)3
③Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3
Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3
(3)上述探究结果说明样品A中含有的离子有
Fe2+、NH4+、SO42-
Fe2+、NH4+、SO42-
.分析:(1)①酸溶液PH增大的原因可从物理或化学变化的角度分析,酸溶液被稀释其PH增大,酸中的氢离子被消耗其PH增大,②氢氧化钠与硫酸反应生成硫酸钠和水根据方程式的写法考虑;(2)设计实验探究硫酸与氢氧化钠溶液的反应是否放热可以通过测定反应前后溶液的温度来进行确定;(3)反应后的溶液中若氢氧化钠剩余,则加入硫酸铜会产生氢氧化铜蓝色沉淀,若无明显现象,则说明无氢氧化钠,剩余溶液可能为中性也可能为酸性.能力提升:根据浅绿色溶液是亚铁离子的溶液,红褐色沉淀是氢氧化铁沉淀,白色沉淀加入硝酸沉淀不溶解,说明该白色沉淀可能是硫酸钡或氯化银沉淀等现象,再结合所给信息进行具体分析即可得出结论.
解答:解:(1)①酸溶液被稀释其PH会增大,所以强调只有测得的PH≥7才能证明反应发生是想说明已经无硫酸了,所以本题答案为:排除因氢氧化钠溶液的加入,稀释硫酸而引起PH变大(或只有PH≥7才能说明硫酸已经反应掉了)
②氢氧化钠与硫酸反应的反应物是氢氧化钠和硫酸写在等号的左边,生成物是硫酸钠和水写在等号的右边,用观察法配平,所以本题答案为:2NaOH+H2SO4=Na2SO4+2H2O
(2)设计实验探究硫酸与氢氧化钠溶液的反应是否放热可以通过测定反应前后溶液的温度来进行确定,所以本题答案为:
(3)氢氧化钠溶液过量,则会和加入的硫酸铜溶液反应生成氢氧化铜蓝色沉淀,硫酸铜和硫酸及硫酸钠都不反应,所以若无现象不能说明恰好完全反应,若要证明,可以加入和酸反应有明显现象的物质,所以本题答案为:生成蓝色沉淀;若盐酸过量,加入硫酸铜溶液时也无明显现象(或硫酸可能有剩余);紫色石蕊试液(或锌粒、碳酸钠、氧化铜、氢氧化铜、pH试纸等);
能力提升:
(1)气体C能使湿润的红色石蕊试纸变蓝,说明该气体显碱性,又因为是加入氢氧化钠得到的碱性气体,所以气体C是氨气,红褐色沉淀就是氢氧化铁沉淀,白色沉淀加入硝酸沉淀不溶解,说明该白色沉淀可能是硫酸钡或氯化银沉淀,又因为是加入硝酸钡后得到的白色沉淀,没有出现银离子,所以白色沉淀是硫酸钡;
(2)由于浅绿色溶液中含有亚铁离子,所以加入氢氧化钠后得到氢氧化亚铁白色沉淀,所以第②个反应的反应物是氢氧化亚铁、氧气、水生成物是氢氧化铁,利用奇偶法配平即可;由加入硝酸钡后得到的白色沉淀,加入硝酸白色沉淀不溶解,说明该白色沉淀是硫酸钡沉淀,说明滤液D中含有硫酸根离子,又因为前面加入了过量的氢氧化钠,所以阳离子有钠离子,所以滤液D中含有硫酸钠,所以第③个反应的反应物是硫酸钠和硝酸钡,生成物是硫酸钡和硝酸钠,用观察法配平即可;
(3)固体样品加入水中,得到浅绿色溶液说明固体样品中含有亚铁离子,气体C能使湿润的红色石蕊试纸变蓝,说明该气体显碱性,又因为是加入氢氧化钠得到的碱性气体,所以气体C是氨气,氢氧根离子与铵根离子结合能产生氨气,所以说明固体样品中含有铵根离子,由加入硝酸钡后得到的白色沉淀,加入硝酸白色沉淀不溶解,说明该白色沉淀是硫酸钡沉淀,说明滤液D中含有硫酸根离子,说明固体样品中含有硫酸根离子.
故答案为:(1)①排除因氢氧化钠溶液的加入,稀释硫酸而引起PH变大(或只有PH≥7才能说明硫酸已经反应掉了);②2NaOH+H2SO4=Na2SO4+2H2O;
(2)
(3)生成蓝色沉淀;若盐酸过量,加入硫酸铜溶液时也无明显现象(或硫酸可能有剩余);紫色石蕊试液(或锌粒、碳酸钠、氧化铜、氢氧化铜、pH试纸等);
能力提升:(1)NH3;Fe(OH)3;BaSO4;(2)②4Fe(OH)2+O2+2H2O═4Fe(OH)3;③Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3;(3)Fe2+、NH4+、SO42-.
②氢氧化钠与硫酸反应的反应物是氢氧化钠和硫酸写在等号的左边,生成物是硫酸钠和水写在等号的右边,用观察法配平,所以本题答案为:2NaOH+H2SO4=Na2SO4+2H2O
(2)设计实验探究硫酸与氢氧化钠溶液的反应是否放热可以通过测定反应前后溶液的温度来进行确定,所以本题答案为:
| 实验步骤 | 实验现象 |
| 取一定量10%的氢氧化钠溶液于烧杯,插入温度计测温度,加入适量10%的硫酸,用玻璃棒搅拌,再测温度. | 温度计示数上升 |
能力提升:
(1)气体C能使湿润的红色石蕊试纸变蓝,说明该气体显碱性,又因为是加入氢氧化钠得到的碱性气体,所以气体C是氨气,红褐色沉淀就是氢氧化铁沉淀,白色沉淀加入硝酸沉淀不溶解,说明该白色沉淀可能是硫酸钡或氯化银沉淀,又因为是加入硝酸钡后得到的白色沉淀,没有出现银离子,所以白色沉淀是硫酸钡;
(2)由于浅绿色溶液中含有亚铁离子,所以加入氢氧化钠后得到氢氧化亚铁白色沉淀,所以第②个反应的反应物是氢氧化亚铁、氧气、水生成物是氢氧化铁,利用奇偶法配平即可;由加入硝酸钡后得到的白色沉淀,加入硝酸白色沉淀不溶解,说明该白色沉淀是硫酸钡沉淀,说明滤液D中含有硫酸根离子,又因为前面加入了过量的氢氧化钠,所以阳离子有钠离子,所以滤液D中含有硫酸钠,所以第③个反应的反应物是硫酸钠和硝酸钡,生成物是硫酸钡和硝酸钠,用观察法配平即可;
(3)固体样品加入水中,得到浅绿色溶液说明固体样品中含有亚铁离子,气体C能使湿润的红色石蕊试纸变蓝,说明该气体显碱性,又因为是加入氢氧化钠得到的碱性气体,所以气体C是氨气,氢氧根离子与铵根离子结合能产生氨气,所以说明固体样品中含有铵根离子,由加入硝酸钡后得到的白色沉淀,加入硝酸白色沉淀不溶解,说明该白色沉淀是硫酸钡沉淀,说明滤液D中含有硫酸根离子,说明固体样品中含有硫酸根离子.
故答案为:(1)①排除因氢氧化钠溶液的加入,稀释硫酸而引起PH变大(或只有PH≥7才能说明硫酸已经反应掉了);②2NaOH+H2SO4=Na2SO4+2H2O;
(2)
| 实验步骤 | 实验现象 |
| 取一定量10%的氢氧化钠溶液于烧杯,插入温度计测温度,加入适量10%的硫酸,用玻璃棒搅拌,再测温度. | 温度计示数上升 |
能力提升:(1)NH3;Fe(OH)3;BaSO4;(2)②4Fe(OH)2+O2+2H2O═4Fe(OH)3;③Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3;(3)Fe2+、NH4+、SO42-.
点评:本题考查了氢氧化钠和硫酸的中和反应,设计实验证明反应是否恰好完全进行以及反应过程中的能量问题,完成此题,可以依据课本已有的知识.所以要求同学们在平时的学习中要加强基础知识的储备,以便能够灵活应用.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
化学物质之间的反应奥妙无穷.在一次化学探究活动中,同学们从不同角度对稀硫酸与氢氧化钠溶液的反应进行了探究,请你参与并填写以下空白.
(1)如何用实验验证稀硫酸与氢氧化钠溶液发生了反应
第一组同学设计了实验方案一:
①请你分析上述方案中为什么强调只有测得的PH≥7才能证明反应发生了?______
______.
②写出稀硫酸与氢氧化钠溶液反应的化学方程式______.
(2)设计实验,探究稀硫酸与氢氧化钠溶液的反应是否放热
实验仪器与药品:10%的硫酸、10%的氢氧化钠溶液、烧杯、温度计、玻璃棒、胶头滴管.
请你完成实验方案设计:
(3)探究稀硫酸与氢氧化钠溶液是否恰好完全反应
第二组同学在做完稀硫酸与氢氧化钠溶液反应的实验后,为探究稀硫酸与氢氧化钠溶液是否恰好完全反应.
设计了实验方案二:
此时有同学提出方案二不能证明稀硫酸与氢氧化钠溶液恰好完全反应,其原因是______.为此,还需要选择______(填一种试剂),再进行实验即可.
能力提升:
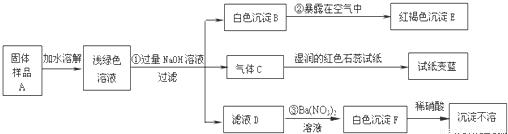
某地新建一化工厂有一种产品属于“复盐”,该产品可用作铁树、棕榈等花木的肥料.某化学课外兴趣小组探究该产品的组成,进行了如下的实验:).
试回答下列问题:
(1)写出下列物质的化学式:C______、E______、F______
(2)写出下列变化的化学方程式:
②______ ③______
(3)上述探究结果说明样品A中含有的离子有______.
(1)如何用实验验证稀硫酸与氢氧化钠溶液发生了反应
第一组同学设计了实验方案一:
| 实验步骤 | 实验现象 | 结论 |
| 先用PH试纸测定稀硫酸的PH,再逐渐滴加氢氧化钠溶液,并不断振荡,同时测定混合液的PH. | PH逐渐变大, 最后 PH≥7 | 稀硫酸与氢氧化钠溶液能发生反应 |
______.
②写出稀硫酸与氢氧化钠溶液反应的化学方程式______.
(2)设计实验,探究稀硫酸与氢氧化钠溶液的反应是否放热
实验仪器与药品:10%的硫酸、10%的氢氧化钠溶液、烧杯、温度计、玻璃棒、胶头滴管.
请你完成实验方案设计:
| 实 验 步 骤 | 实验现象 | 结论 |
| 稀硫酸与氢氧化钠溶液反应放热 |
第二组同学在做完稀硫酸与氢氧化钠溶液反应的实验后,为探究稀硫酸与氢氧化钠溶液是否恰好完全反应.
设计了实验方案二:
| 实验步骤 | 实验现象 | 结论 |
| 取少量上述反应后的溶液于试管中,滴加硫酸铜溶液. | 若______ | 氢氧化钠溶液过量 |
| 若没有明显现象 | 稀硫酸与氢氧化钠溶液恰好完全反应 |
能力提升:
某地新建一化工厂有一种产品属于“复盐”,该产品可用作铁树、棕榈等花木的肥料.某化学课外兴趣小组探究该产品的组成,进行了如下的实验:).

试回答下列问题:
(1)写出下列物质的化学式:C______、E______、F______
(2)写出下列变化的化学方程式:
②______ ③______
(3)上述探究结果说明样品A中含有的离子有______.
24.(2008?沈阳)化学物质之间的反应奥妙无穷.在一次化学探究活动中,同学们从不同角度对稀盐酸与氢氧化钠溶液的反应进行了探究,请你参与并填写以下空白.
(1)如何用实验验证稀盐酸与氢氧化钠溶液发生了反应
第一组同学设计了实验方案一:
①请你分析上述方案中为什么强调只有测得的PH≥7才能证明反应发生了?______.
②写出稀盐酸与氢氧化钠溶液反应的化学方程式______.
(2)设计实验,探究稀盐酸与氢氧化钠溶液的反应是否放热提供的实验仪器与药品:
10%的盐酸、10%的氢氧化钠溶液、烧杯、温度计、玻璃棒、胶头滴管.
(3)探究稀盐酸与氢氧化钠溶液是否恰好完全反应请你完成实验方案设计:
第二组同学在做完稀盐酸与氢氧化钠溶液反应的实验后,为探究稀盐酸与氢氧化钠溶液是否恰好完全反应,设计了实验方案二:
此时有同学提出方案二不能证明稀盐酸与氢氧化钠溶液恰好完全反应,其原因是______.
为此,还需要选择______(填一种试剂),再进行实验即可.
(1)如何用实验验证稀盐酸与氢氧化钠溶液发生了反应
第一组同学设计了实验方案一:
| 实验步骤 | 实验现象 | 结论 |
| 先用pH试纸测定稀盐酸的pH,再逐渐滴加氢氧化钠溶液,并不断振荡,同时测定混合液的pH. | pH逐渐变大,最后pH≥7 | 稀盐酸与氢氧化钠溶液发生反应 |
②写出稀盐酸与氢氧化钠溶液反应的化学方程式______.
(2)设计实验,探究稀盐酸与氢氧化钠溶液的反应是否放热提供的实验仪器与药品:
10%的盐酸、10%的氢氧化钠溶液、烧杯、温度计、玻璃棒、胶头滴管.
(3)探究稀盐酸与氢氧化钠溶液是否恰好完全反应请你完成实验方案设计:
第二组同学在做完稀盐酸与氢氧化钠溶液反应的实验后,为探究稀盐酸与氢氧化钠溶液是否恰好完全反应,设计了实验方案二:
| 实验步骤 | 实验现象 | 结论 |
| 取少量上述反应后的溶液于试管中,滴加硫酸铜溶液. | 若______________ | 氢氧化钠溶液过量 |
| 若没有明显现象 | 稀盐酸与氢氧化钠溶液恰好完全反应 |
为此,还需要选择______(填一种试剂),再进行实验即可.