题目内容
【题目】某工厂产生的烧渣(主要含FeO、Fe2O3,还有一定量的SiO2)可用于制备七水合硫酸亚铁晶体(FeSO47H2O),其工艺流程如下:
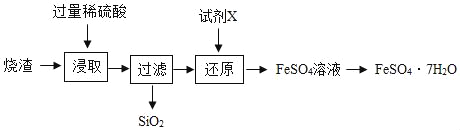
查阅资料:SiO2不溶于水,也不与稀硫酸反应。
(1)“浸取”步骤中,FeO、Fe2O3和稀硫酸发生反应的化学方程式分别为FeO+H2SO4=FeSO4+H2O、________________________________。
(2)为提高“浸取”步骤的反应速率,可采取的具体措施有___________________(写2条,不考虑“搅拌”和“使用催化剂”)。
(3)“还原”步骤的目的是将Fe3+转化为Fe2+,试剂X可用SO2或Fe。
①若试剂X是SO2,转化原理为SO2+Fe2 (SO4)3+2Y═2FeSO4+2H2SO4,则Y的化学式是________。
②若试剂X是Fe,转化原理为Fe+Fe2 (SO4)3=3FeSO4.测得“还原”后溶液的pH明显增大,其原因是__________________________________。
【答案】Fe2O3+3H2SO4=Fe2(SO4)3+3H2O。增大硫酸的浓度或升高温度。H2O。铁消耗过量的硫酸,溶液酸性减弱。
【解析】
(1)“浸取”步骤中,FeO、Fe2O3和稀硫酸发生反应的化学方程式分别为:FeO+H2SO4=FeSO4+H2O、Fe2O3+3H2SO4= Fe2(SO4)3+3H2O;
(2)为提高“浸取”步骤的反应速率,可采取的具体措施有:增大硫酸的浓度,升高温度,将烧渣粉碎等;
(3)①由反应的化学方程式可知,反应前后硫原子都是4个,铁元素都是2个,反应后氧原子是16个,反应前应该是16个,其中2个包含在2Y中,反应后氢原子是4个,反应前应该是4个,都包含在2Y中,因此Y是H2O;
②若试剂X是Fe,转化原理为Fe+Fe2(SO4)3=3FeSO4,测得“还原”后溶液的pH明显增大,其原因是铁消耗过量的硫酸,溶液酸性减弱。

 阅读快车系列答案
阅读快车系列答案【题目】某同学从定量角度研究双氧水制取氧气的过程,对原实验进行部分改进,增加了称量操作.具体做法是:取10%的双氧水和少量的二氧化锰放入气体发生装置,并对反应前后混合物的质量进行称量,记录如下:
反应过程 | 反应前 | 反应后 |
质量变化(不含容量质量) | 34.3g | 32.7g |
若反应后,双氧水分解完全且氧气全部逸出,该同学得出的结论中,不合理的是:
A.反应速率逐渐加快 B.最多得到氧气的质量为1.6g
C.催化剂二氧化锰的质量为0.3g D.反应得到水和氧气的质量比为9:8
【题目】设计方案是实验探究的保证,感悟方法是探究的根本目的.某化学学习小组欲对实验室失去标签的三瓶无色溶液A、B、C的成分进行探究,它们可能是NH4Cl溶液、NaOH溶液、Na2CO3溶液中的一种,探究过程如下:
(分析)从组成上看,NH4Cl属于铵盐,含有NH4+,与强碱溶液反应会有氨气产生,NaOH溶液和Na2CO3溶液中因为含有不同阴离子,所以性质不同,据此可鉴别.
(设计方案并实验)
实验操作 | 现象 | 结论 |
(1)小红分别取适量A、B、C三种溶液于三只试管中,再分别加入氢氧化钠溶液微热 | A中产生有刺激性气味的气体,B、C中无气味 | A是NH4Cl溶液. A与氢氧化钠溶液反应的化学方程式:______________. |
(2)小贝分别取适量B、C两种溶液于两只试管中,再分别滴加酚酞溶液 | 酚酞溶液变红 | B、C都是NaOH溶液 |
(3)小明也分别取适量B、C两种溶液于两只试管中,再分别滴加______________. | ______________ | B是Na2CO3溶液 C是NaOH溶液 |
(反思与评价)小组同学讨论后一致认为小贝的结论不正确,理由是______________.
(方法感悟)在检验物质时,要分析物质的组成和______________,据此选择加入适当的试剂,最后根据不同现象得出结论.
(问题处理)几天后,小明才发现取完C后忘了及时盖上瓶塞,若要除去其中杂质,可向其中加入适量的________________________溶液.