��Ŀ����
����Ŀ��ijͬѧ�Ӷ����Ƕ��о�˫��ˮ��ȡ�����Ĺ���,��ԭʵ����в��ָĽ�,�����˳�������.����������:ȡ10%��˫��ˮ�������Ķ������̷������巢��װ��,���Է�Ӧǰ��������������г���,��¼����:
��Ӧ���� | ��Ӧǰ | ��Ӧ�� |
�����仯(������������) | 34.3g | 32.7g |
����Ӧ��,˫��ˮ�ֽ���ȫ������ȫ���ݳ�,��ͬѧ�ó��Ľ�����,����������:
A����Ӧ�����ӿ� B�����õ�����������Ϊ1.6g
C�������������̵�����Ϊ0.3g D����Ӧ�õ�ˮ��������������Ϊ9:8
���𰸡�A
��������������ȡ������֪ʶ���з�������Ӧ���Ũ��Ӱ�컯ѧ��Ӧ�����ʣ���Ӧ���Ũ��Խ��ӦԽ���ң��������ʵ����������������������������ݷ�Ӧ�Ļ�ѧ����ʽ����ȷ�����ɵ�ˮ�������������ȣ��Լ�����������������Ӷ���ö������̵�������A�����ŷ�Ӧ�Ľ��У�����������Һ��Ũ����С���ʷ�Ӧ������С����A�Ľ��۲�������B�����������غ㶨�ɣ���Ӧǰ���ʵ������ܺ͵��ڷ�Ӧ�����ʵ������ܺͣ���������������Ϊ��34.3g��32.7g=1.6g����B���ۺ����� C��������1.6g������Ҫ�������������Ϊx
2H2O2![]() 2H2O+O2��
2H2O+O2��
68 32
x 1.6g
![]()
x=3.4g
���Թ���������Һ������Ϊ��3.4g��10%=34g
�������̵�����Ϊ��34.3g��34g=0.3g
��C���ۺ����� D��2H2O2![]() 2H2O+O2��
2H2O+O2��
36 32
ˮ��������������Ϊ36��32=9��8��
��D���ۺ�������ѡA��

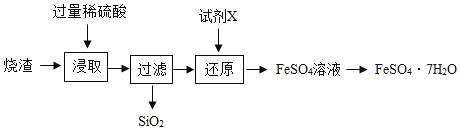
����Ŀ��![]() �꣬������ѧ�ҿ�������˹���쵼���о�С��ɹ�����ȡ��������С�ĵ�
�꣬������ѧ�ҿ�������˹���쵼���о�С��ɹ�����ȡ��������С�ĵ�![]() ����ѧʽΪ
����ѧʽΪ![]() ��������ȡ��
��������ȡ��![]() ��ʵ���У����������˱�ը���ݻ���ʵ���ҵIJ����豸����ˣ���ѧ������Ϊ����������������ʱ����ȶ����������ܻ��Ϊ����͵���������ȼ�ϣ���
��ʵ���У����������˱�ը���ݻ���ʵ���ҵIJ����豸����ˣ���ѧ������Ϊ����������������ʱ����ȶ����������ܻ��Ϊ����͵���������ȼ�ϣ���![]() �������г�
�������г�![]() �ε�
�ε�![]() ����ԭ�ӽ�϶��ɵģ���ѧ���ʼ����ȶ����������������ش��������⣺
����ԭ�ӽ�϶��ɵģ���ѧ���ʼ����ȶ����������������ش��������⣺
![]() �Ƚϵ����͵�
�Ƚϵ����͵�![]() ����ͬ��
����ͬ��
���� | �� | ||
��ͬ�� | ���ӹ��� | ______ | ______ |
�������� | ______ | ______ | |
��ѧ���� | ______ | ______ | |
��ͬ�� | ______ | ||
![]() ��������һ��
��������һ��![]() ��Ӧ����������Щ��;��������д������
��Ӧ����������Щ��;��������д������
________��
����Ŀ�������Ԫ�����ڱ��еIJ�����Ϣ,A��B��C��D�ֱ����������ӵĽṹʾ��ͼ�������������Ϣ�����Ҫ����ա�
3 Li � | 4 Be �� | 5 B �� | 6 C ̼ | 7 N �� | 8 O �� | 9 F �� | 10 Ne �� |
11 Na �� | 12 Mg þ | 13 Al �� | 14 Si �� | 15 P �� | 16 S �� | 17 Cl �� | 18 Ar � |
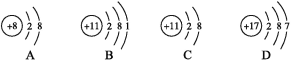
(1)��Ԫ�ص�ԭ�ӵĺ��������Ϊ_______��
(2)A��B��C��D����������,�õ�����,�γ��ȶ��ṹ����_______ (����ĸ���)��
(3)ij���Ӵ�2����λ�����,��ṹʾ��ͼ��ͼ��ʾ:![]() �����ӵķ�����_______��
�����ӵķ�����_______��