��Ŀ����
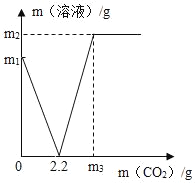
����Ŀ��ij��ѧ��ȤС��ȡ���ֱ��ʵ�Ca��OH��2 ��������CaCO3����Ʒ8.7gͶ��184.7gˮ�У���ֽ��裬ͨ������CO2����Һ�����뷴Ӧ��CO2�����Ĺ�ϵ��ͼ��ʾ[��֪CaCO3+H2O+CO2=Ca��HCO3��2]����
��1��Ca��OH��2ȫ��ת��ΪCaCO3ʱ���ĵ�CO2����Ϊ______
��2��8.7g��Ʒ������CaCO3������Ϊ���٣�______��д��������̣�
��3��ͨ��mgCO2ʱ����Һ������������ʵ���������Ϊ______��ȷ��0.1%����
���𰸡�2.2g��5g��8.1%��
��������
��1����ͼʾ��֪Ca��OH��2��CO2��Ӧȫ��ת��ΪCaCO3ʱ���ĵ�CO2��������2�����Ca��OH��2��CO2��Ӧ�Ļ�ѧ����ʽ����CO2�������ɼ����Ca��OH��2���������������4.0g��Ʒ������CaCO3����������3������������ȫ��ת��Ϊ̼���ʱ������ͨ������̼�ͻ���̼��Ʒ�Ӧ���ɿ����Ե�̼�������Һ�����ͻ�����һ������Ӧ����������̼��Ƶ��������ɼ��������������������������غ㶨�������㷴Ӧ����Һ�������ɽ��
��1����ͼʾ��֪Ca��OH��2��CO2��Ӧȫ��ת��ΪCaCO3ʱ���ĵ�CO2������2.2g��
��2����8.7g��Ʒ��Ca��OH��2����Ϊx������̼��Ƶ�����Ϊy��
CO2+Ca��OH��2�TCaCO3��+H2O
44 74 100
2.2g x y
![]()
x=3.7g
y=5g
8.7g��Ʒ������CaCO3������Ϊ��8.7g��3.7g=5g��
��3����̼���ȫ���ܽ�ʱ���Ķ�����̼������Ϊm������̼����Ƶ�����Ϊn��
CaCO3+H2O+CO2=Ca��HCO3��2
100 44 162
10g m n
![]()
m=4.4g
n=16.2g
ͨ��mgCO2ʱ����Һ������������ʵ���������Ϊ![]() ��100%=8.1%��
��100%=8.1%��