题目内容
【题目】今年“五·一”假期,小丽随爸爸到乡下省亲,期间看到许多漂亮的大理石。于是她带了一些回来,想去学校实验室测定这些大理石中碳酸钙的含量。她称取了20克大理石样品置于烧杯中,然后将250g稀盐酸分成五等份,依次加入烧杯充分反应,记录有关实验数据如下表所示(大理石中其他成分均不溶于水,也不参与化学反应)。
加入次数 | 一 | 二 | 三 | 四 | 五 |
加入稀盐酸的质量/g | 50 | 50 | 50 | 50 | 50 |
烧杯中剩余固体的质量/g | 15 | 10 | 5 | 5 | m |
试求:(1)m的值应为_____;
(2)实验中大理石样品所含碳酸钙的质量分数?
(3)实验中所用稀盐酸的溶质质量分数?
【答案】(1)5(2)75%(3)7.3%
【解析】
(1)根据前三次实验可知,每加入50g的稀盐酸,固体就会减少5g。而第三次后,固体不再减少,则说明此时剩余的5g为杂质,不会发生反应。则可以分析出,第五次烧杯剩余的固体的质量依然为5g。故答案为:5;
(2)根据(1),则可以分析出碳酸钙的质量为:20g-5g-15g,则碳酸钙的质量分数为:![]() 。故答案为:75%;
。故答案为:75%;
(3)根据前三次实验可知,每加入50g的酸,就会消耗5g的碳酸钙。由于第一次、第二次实验后加入酸,样品的质量减少,则第一次、第二次实验中碳酸钙有剩余,而第三次实验结束后,再加入50g的酸,剩余固体不变,则此时碳酸钙已经被消耗,则第四次、第五次实验中的酸过量。根据每加入50g的酸就会消耗5g的碳酸钙可知,第三次为恰好完全反应。
设恰好完全反应时,共消耗的稀盐酸的溶质质量为x。
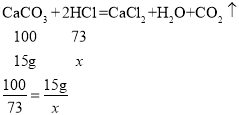
解得x=10.95g
则稀盐酸的溶质质量分数为:![]() ,写出答即可。
,写出答即可。

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目