题目内容
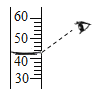
【题目】向硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为m的锌粉,溶液中析出固体的质量与参加反应的锌粉质量关系如图所示。
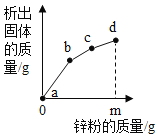
(1)c点对应溶液中含有哪些金属离子?_____(用离子符号表示)
(2)cd段(不含两端点)涉及的反应中析出的是哪种金属?_____。
(3)若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2,则m1_____m2(填“大于”“等于”或“小于”)。
【答案】Zn2+、Fe2+ 铁 小于
【解析】
根据锌比铁活泼,铁比铜活泼,铜比银活泼,往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为m的锌粉,锌先和硝酸银反应生成硝酸锌和银,再和硝酸铜反应生成硝酸锌和铜,最后和硝酸亚铁反应生成硝酸锌和铁,据此分析解答即可。
:锌比铁活泼,铁比铜活泼,铜比银活泼,往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为m的锌粉,锌先和硝酸银反应生成硝酸锌和银,再和硝酸铜反应生成硝酸锌和铜,最后和硝酸亚铁反应生成硝酸锌和铁,故ab段是锌和硝酸银反应,bc段是锌和硝酸铜反应,cd段是锌和硝酸亚铁反应;
(1)达到c点,硝酸银和硝酸铜都已经反应完,故含有的金属阳离子是锌离子和亚铁离子,符号为:Zn2+、Fe2+;
(2)cd段是锌和硝酸亚铁反应,故析出的金属是铁;
(3)bc段和cd段析出固体分别是铜、铁,质量都是m,根据题意有:
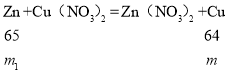
![]()
m1=![]() ;
;
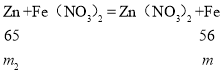
![]()
m2=![]() ;
;
故m1<m2。

 阅读快车系列答案
阅读快车系列答案【题目】今年“五·一”假期,小丽随爸爸到乡下省亲,期间看到许多漂亮的大理石。于是她带了一些回来,想去学校实验室测定这些大理石中碳酸钙的含量。她称取了20克大理石样品置于烧杯中,然后将250g稀盐酸分成五等份,依次加入烧杯充分反应,记录有关实验数据如下表所示(大理石中其他成分均不溶于水,也不参与化学反应)。
加入次数 | 一 | 二 | 三 | 四 | 五 |
加入稀盐酸的质量/g | 50 | 50 | 50 | 50 | 50 |
烧杯中剩余固体的质量/g | 15 | 10 | 5 | 5 | m |
试求:(1)m的值应为_____;
(2)实验中大理石样品所含碳酸钙的质量分数?
(3)实验中所用稀盐酸的溶质质量分数?