题目内容
【题目】取碳酸钠和氯化钠的固体混合物13.6g,与质量为73g的稀盐酸恰好完全反应,产生二氧化碳气体的质量为4.4g。计算:
(1)固体混合物中碳酸钠的质量_____。
(2)该稀盐酸中溶质的质量分数_____。
(3)反应所得的溶液中溶质的质量分数_____(要计算过程,最后结果保留一位小数)。
【答案】10.6g 10% 17.9%
【解析】
(1)设固体混合物中碳酸钠的质量为x,稀盐酸中溶质的质量为y,生成氯化钠的质量为z
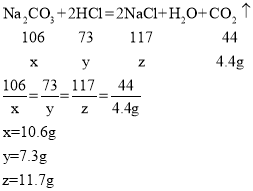
答:固体混合物中碳酸钠的质量10.6g。
(2)该稀盐酸中溶质的质量分数为:![]() =10%。
=10%。
(3)反应所得的溶液的质量为:13.6g+73g-4.4g=82.2g
反应所得的溶液中溶质的质量为:11.7g+(13.6g-10.6g)=14.7g
反应所得的溶液中溶质的质量分数:![]() 。
。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目