题目内容
【题目】(5分)中和反应是酸与碱生成盐和水的反应,请你回答以下问题:
(1)下列事实不能表明盐酸与氢氧化钠发生了反应的是
A.向氢氧化钠固体中加入盐酸后,混合溶液的温度升高
B.向氢氧化钠溶液中加入盐酸后,混合溶液的质量增大
C.向滴有酚酞的氢氧化钠溶液中加入盐酸后,红色褪去
D.向氢氧化钠溶液中加入盐酸后,混合溶液的pH<7
(2)化学兴趣小组在进行酸碱中和反应的课外研究时做了如下实验:向装有50g稀硫酸的小烧杯中,慢慢滴加Ba(OH)2饱和溶液至过量,并测定了其溶液的温度、电导率变化曲线。请回答以下问题:
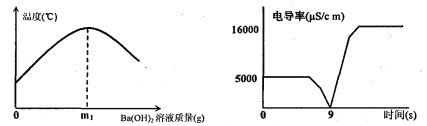
①请写出稀硫酸与氢氧化钡溶液反应的化学方程式 。
②稀硫酸溶液能导电,是因为其溶液中有自由移动的 (填微粒符号),当加入质量为m1g的Ba(OH)2溶液时,溶液导电性几乎为0,其原因是 。
③经过实验探究他们对中和反应的现象进行了归类并提出猜想:
I酸碱溶液混合时无明显现象,如氢氧化钠溶液与稀盐酸混合;
II酸碱溶液混合时产生白色沉淀,如氢氧化钡溶液与稀硫酸混合;
Ⅲ请你模仿I和II,再举出一种酸碱中和有明显现象的实例 。
【答案】(1)A 、反应后没有生成沉淀或气体,溶液质量不变
(2)①Ba(OH)2+H2SO4==BaSO4↓+2H2O;②SO42-; H+;氢氧化钡与稀硫酸反应,生成白色沉淀硫酸钡和水,液体中几乎没有能够自由移动的离子;③难溶性碱与酸溶液反应,如氢氧化铜与稀硫酸反应。
【解析】
试题分析:(1)A、氢氧化钠固体溶解于水时,也会放出热量;B 、反应后没有生成沉淀或气体,溶液质量不变(2)①化学方程式为:Ba(OH)2+H2SO4==BaSO4↓+2H2O;②硫酸溶液中存在SO42-; H+;氢氧化钡与稀硫酸反应,生成白色沉淀硫酸钡和水,液体中几乎没有能够自由移动的离子;③难溶性碱与酸溶液反应,如氢氧化铜与稀硫酸反应。