题目内容
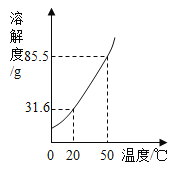
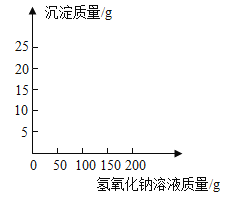
【题目】某锥形瓶盛有盐酸和氯化铜的混合溶液100g,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量与滴入的氢氧化钠溶液的质量的变化关系如图所示。请计算:
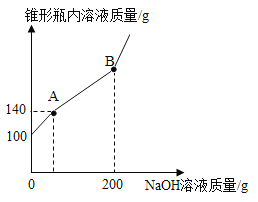
(1)反应至A点时加入氢氧化钠溶液的质量为________;
(2)计算反应至原溶液中氯化铜的溶质质量分数为多少?_______
(3)在下图中画出加入氢氧化钠溶液质量与生成沉淀的关系图像(标出必要的数据)。_______
【答案】40g 27% 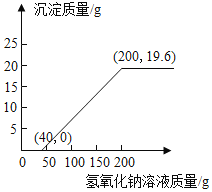
【解析】
向盐酸和氯化铜的混合溶液中逐滴加入氢氧化钠溶液,优先发生酸碱中和反应,即氢氧化钠先与盐酸反应生成氯化钠和水,待盐酸反应完后,氢氧化钠再与氯化铜反应生成氢氧化铜沉淀和氯化钠。
(1)根据曲线变化可知,第一段是盐酸和氢氧化钠反应,此时没有气体或沉淀生成,所以加入的氢氧化钠溶液的质量为140g-100g=40g;
(2)第二段曲线是氯化铜和氢氧化钠反应,消耗的氢氧化钠溶液的质量为200g-40g=160g;
设原溶液中氯化铜的溶质质量分数为x,生成的氢氧化铜的质量为y。
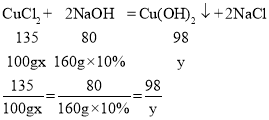
解得:x=27%,y=19.6g
答:原溶液中氯化铜的溶质质量分数为27%;
(3)加入40g氢氧化钠溶液才有沉淀生成,加入氢氧化钠溶液到200g时沉淀达到最大量,为19.6g。加入氢氧化钠溶液质量与生成沉淀的关系图像如下:
 。
。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】有一种自生氧防毒面具,其使用的生氧剂的主要成分是KO2。某研究小组取100 g生氧剂放入装置A中,加入足量水使之充分反应(4KO2+2H2O=4KOH+3O2↑),测定反应前后装置A的总质量。他们进行了三次实验,测定结果如下:
测定序号 | 第1次 | 第2次 | 第3次 | 平均值 |
反应前装置A总质量(g) | 400.1 | 400.2 | 399.7 | 400.0 |
反应后装置A总质量(g) | 376.1 | 376.1 | 375.8 | 376.0 |
请根据上述实验结果计算:(假设杂质不含钾元素且不与水反应)
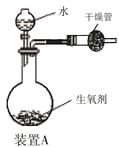
(1)100 g 生氧剂与水反应生成的氧气质量;
(2)生氧剂中含钾元素的质量分数。
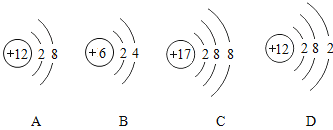
【题目】对下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
实 验 装 置 |
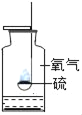
硫在氧气中燃烧 |
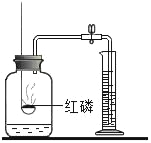
测定空气中氧气含量 |
测定空气中氧气含量 |
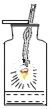
铁丝在氧气中燃烧 |
解释 | 集气瓶中的水: 吸收放出的热量 | 集气瓶中的水: 更快地吸收白烟 | 量筒中的水: 通过水体积的变化得出氧气体积 | 集气瓶中的水: 冷却溅落融熔物,防止集气瓶炸裂 |
A | B | C | D |
A. AB. BC. CD. D
【题目】水泥厂化验室为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量的 10% 的稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水)。有关实验数据如下表: 请计算:
反应前 | 反应后 | ||
实验数据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
268.8g | 20g | 282.2g | |
(1)理论上得到二氧化碳气体_____克;
(2)该石灰石样品中中碳酸钙的质量分数_____。