题目内容
【题目】化学实验室要从含少量铜粉的银、锰(Mn)混合金属粉末中分离出贵金属,并获得一种盐晶体,将有关三种金属随意编号为A、B、C并设计了如图实验方案。
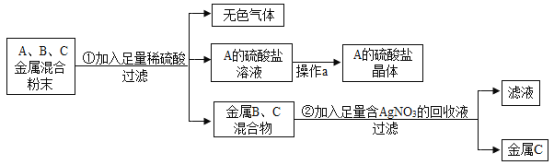
(1)A、B、C三种金属的活动性顺序为_____。
(2)已知A的硫酸盐中A元素显+2价,请写出①中发生反应的化学方程式_____。
(3)判断②中过滤后所得的滤液中AgNO3是否有剩余,可加入_____确定。
【答案】A>B>C ![]() 稀盐酸等
稀盐酸等
【解析】
(1)由图可知,A能与硫酸反应,而B、C不能与硫酸反应,说明A的活动性比B、C的强;将B、C金属混合物加入足量的硝酸银溶液中,B反应,C没有反应,说明B的活动性比C的强,三种金属的活动性顺序为A>B>C;
(2)铜、锰、银三种金属中,锰在金属活动性顺序表中排在氢前,能与稀硫酸反应,所以A为锰,已知A的硫酸盐中A元素显+2价,①中发生反应的化学方程式![]() ;
;
(3)硝酸银溶液能与稀盐酸(或氯化钠溶液等)生成氯化银白色沉淀,判断②中过滤后所得的滤液中AgNO3是否有剩余,可通过加入与稀盐酸(或氯化钠溶液等),如果生成白色沉淀,则有硝酸银,反之,则没有。

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目