题目内容
【题目】化学课堂上,同学们分小组合作探究碳酸钠的性质,请你参与探究并填空。
(实验记录与分析)
实验一 | 实验二 | 实验三 | 实验四 | |
实验操作 |
|
|
|
|
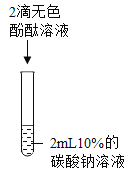
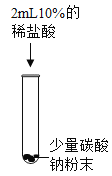
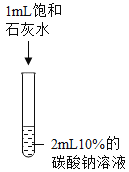
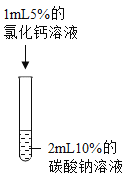
实验现象 | 溶液由无色变为红色 | _______ | 生成白色沉淀 | 生成白色沉淀 |
实验结论 | 碳酸钠溶液显____性 | 碳酸钠能与盐酸发生反应 | 碳酸钠能与氢氧化钙发生反应 | ______ |
(反思与拓展)
(1)甲同学分析实验一得出:盐溶液____(选填“一定”或“不一定”)显中性。
(2)乙同学用稀硫酸代替实验二中的稀盐酸进行探究,发现实验现象相同。从微观角度分析,这是因为稀盐酸和稀硫酸中都含有_____。
(3)丙同学对比实验三和实验四的现象,从微观角度分析,两个反应的实质相同,溶液中相互结合的离子都是_______。
【答案】固体粉末消失,有气泡产生 碱 碳酸钠能与氯化钙发生反应 不一定 氢离子(或H+) 钙离子和碳酸根离子(或Ca2+和CO32-)
【解析】
[实验记录与分析]
实验一:该实验是2滴无色酚酞溶液滴入碳酸钠溶液中,实验现象是溶液由无色变为红色,因为酚酞溶液遇碱性溶液会变红,所以该实验可以得出的结论是:碳酸钠溶液显碱性;
实验二:该实验是盐酸加入少量碳酸钠粉末中,因为碳酸钠能与盐酸发生反应生成二氧化碳气体,所以实验现象应该是:固体粉末消失,有气泡产生;
实验四:氯化钙溶液加入碳酸钠溶液中生成白色沉淀,这是因为氯化钙溶液和碳酸钠溶液反应生成了碳酸钙沉淀,该实验可以得出的结论是:碳酸钠能与氯化钙发生反应。
[反思与拓展]
(1)有些盐溶液显中性,如氯化钠等强酸强碱盐;有些盐溶液显酸性,如硫酸铜等强酸弱碱盐;有些盐溶液显碱性,如本题中的碳酸钠等强碱弱酸盐。实验一的现象是溶液由无色变为红色,无色酚酞溶液遇碱性溶液才会变红,因此甲同学根据实验一的现象,可知碳酸钠溶液显碱性,故可以得出结论:盐溶液不一定显中性。
(2)乙同学用稀硫酸代替实验二中的稀盐酸进行探究,发现实验现象相同,这就说明稀硫酸也能和碳酸钠反应生成二氧化碳气体。从微观角度分析,这是因为稀盐酸和稀硫酸中都含有氢离子(或H+),氢离子和碳酸根离子结合生成二氧化碳和水。
(3)实验三和实验四的现象都是生成白色沉淀,这是因为两个反应中都生成难溶于水的碳酸钙。从微观角度分析,氢氧化钙和碳酸钠反应生成白色沉淀的原因是:氢氧化钙溶液中的钙离子和碳酸钠溶液中的碳酸根离子结合生成碳酸钙沉淀;氯化钙和碳酸钠反应生成白色沉淀的原因是:氯化钙溶液中的钙离子和碳酸钠溶液中的碳酸根离子结合生成碳酸钙沉淀。因此这两个反应的实质相同,溶液中相互结合的离子都是钙离子和碳酸根离子(或Ca2+和CO32-)。